© 2022, Турчин Дмитрий Викторович 4240


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

ВПР Химия 11 класс
Список вопросов теста
Вопрос 1
Из курса химии Вам известны следующие методы познания веществ и явлений: наблюдение,
эксперимент, измерение, моделирование и др.
На рис. 1–3 изображены примеры применения некоторых из этих методов.

Определите, какие из изображённых на рисунках методов можно применить для:
1) качественного анализа состава сульфата меди(II);
2) иллюстрации химического строения вещества.
Выбирите название метода познания и соответствующий этому методу номер рисунка
Варианты ответов
- 1)наблюдение, рис. 1
- 1)эксперимент, рис. 1
- 2)измерение, рис. 2
- 2)моделирование, рис. 3
Вопрос 2
На рисунке изображена модель электронного строения атома некоторого химического
элемента.
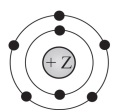
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических
элементов Д.И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует
этот химический элемент.
Выбирите правильный ответ
Варианты ответов
- 1) - Ca, 2)№ периода - II, № группы IIА
- 1) - N, 2)№ периода - II, № группы VА
- 1) - P, 2)№ периода - II, № группы IIБ
Вопрос 3
Периодическая система химических элементов Д.И. Менделеева – богатое хранилище
информации о химических элементах, их свойствах и свойствах их соединений.
Так, например, известно, что с увеличением порядкового номера химического элемента
способность атомов принимать электроны – электроотрицательность – в периодах
усиливается, а в группах ослабевает.
Учитывая эти закономерности, расположите в порядке увеличения электроотрицательности
следующие элементы: хлор, кремний, сера, фосфор. В ответе запишите символы элементов
в нужной последовательности.
Варианты ответов
- хлор, кремний, сера, фосфор
- фосфор, хлор, кремний, сера
- сера, хлор, кремний, фосфор
- кремний, фосфор, сера, хлор,
Вопрос 4
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют
молекулярное и ионное строение.
Используя данную информацию, определите, какое строение имеют вещества азот (N2)
и поваренная соль (NaCl). Запишите ответ в отведённом месте.
Варианты ответов
- 1) азот (N2) - Молекулярного строения
- 1) азот (N2) - Ионного строения
- 2) поваренная соль (NaCl) - Молекулярного строения
- 2) поваренная соль (NaCl) - Ионного строения
Вопрос 5
Аммиак (NH3) в промышленности получают взаимодействием азота и водорода при
температуре 400–450оС под давлением в присутствии катализатора. В лаборатории аммиак
можно получить, например, взаимодействием хлорида аммония (NH4Cl) со щелочами
(например, Ca(OH)2). Аммиак – газ с характерным резким запахом, очень хорошо
растворяется в воде. Водный раствор аммиака называется аммиачная вода или нашатырный
спирт. С его помощью можно привести в чувство человека при обмороке, хирурги
обрабатывают им руки перед операцией. Помимо того, этот препарат нашёл широкое
применение в косметологии.
Аммиак легко взаимодействует с кислотами, образуя соли аммония. Так, аммиак
с азотной кислотой (HNO3) образует нитрат аммония (NH4NO3). За счёт азота в степени
окисления –3 аммиак может проявлять восстановительные свойства, взаимодействуя с
кислородом, оксидом меди(II) (CuO) или другими окислителями. Аммиак является исходным
веществом для получения в промышленности азотной кислоты и азотных удобрений.
Сложные неорганические вещества условно можно распределить, т. е. классифицировать, по
четырём группам, как показано на схеме. Используя формулы приведённых в тексте
веществ, впишите в схему по одной формуле вещества соответствующего класса.
Варианты ответов
- (NH3) - оксид
- (HNO3) - соль
- (NH4NO3) - соль
- (CuO) - основание
- Ca(OH)2) - основание
- (HNO3) - кислота
- (CuO) - оксид
Вопрос 6
1. Составьте молекулярное уравнение реакции получения аммиака из простых веществ
Варианты ответов
- N + H = NH3
- 2N + 3H = NH3
- N2 + 3H2 = 2NH3
- N3 + H2 = 2NH3
Вопрос 7
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
Варианты ответов
- с поглощением
- выделением теплоты
Вопрос 8
1. Составьте молекулярное уравнение упомянутой в тексте реакции между аммиаком
и азотной кислотой.
Варианты ответов
- 2NH3 + HNO3 = (NH4)2NO3
- NH3 + 2HNO3 = NH4(NO3)2
- NH3 + HNO3 = NH4NO3
Вопрос 9
2. Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
Варианты ответов
- соединения
- разложения
- замещения
- обмена
Вопрос 10
В исследованной воде из местного колодца были обнаружены следующие катионы металлов:
NH4+, K+, Ba2+. Для проведения качественного анализа к этой воде добавили раствор Na2SO4.
1. Какие изменения в растворе наблюдаются при проведении данного опыта (концентрация
веществ достаточная для проведения анализа).
Варианты ответов
- выделяется газ
- образуется осадок
- изменяется цвет
- появляется характерный запах
Вопрос 11
Дана схема окислительно-восстановительной реакции.
HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
1. Составьте электронный баланс этой реакции.
Варианты ответов
- Н(+1) + 1е- = 2Н(+1) ; Сu(0) + 1e- = Cu(+1)
- N(+5) + 1e- = N(+4) ; Сu(0) - 2e- = Cu(+2)
- Н(+1) + 1е- = 2Н(+1) ; 3O(-2) - 1e- = O2 (0)
Вопрос 12
2. Укажите окислитель и восстановитель.
Варианты ответов
- Н -окислитель ; Сu -восстановитель.
- N - восстановитель; Сu -окислитель
- Н - окислитель ; О - восстановитель
- N - окислитель; Сu -восстановитель
Вопрос 13
3. Расставьте коэффициенты в уравнении реакции
Варианты ответов
- 2HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
- 4HNO3 + Cu → Cu(NO3)2 + 2NO2 + 2H2O
- 4HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
Вопрос 14
Дана схема превращений:
Na2S → H2S → SO2 → BaSO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить
указанные превращения.
Варианты ответов
- 1Na2S → H2S 2H2S → SO2 3SO2 → BaSO3
- 1Na2S + HCl → H2S + NaCl 2H2S + O2 → SO2 + H2O 3SO2 + Ba→ BaSO3
- 1Na2S + 2HCl = 2NaCl + H2S 2H2S + 3O2 = 2SO2 + 2H2O 3SO2 + Ba(OH)2 = BaSO3 + H2O
Вопрос 15
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице
классам/группам органических соединений. 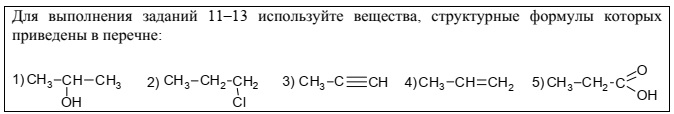 Запишите в таблицу структурные формулы
Запишите в таблицу структурные формулы
соответствующих веществ
Варианты ответов
- Алкин - 1)
- Карбоновая кислота -5)
- Карбоновая кислота - 2)
- Алкин - 3)
Вопрос 16
В предложенные схемы химических реакций впишите структурные формулы пропущенных
веществ, выбрав их из приведённого выше перечня.
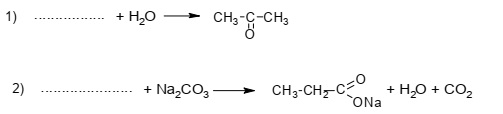
Варианты ответов
- CHC-CH3
- CH2 = CH - CH3
- CH3 -CH2 - COOH
- CH3 - CCH
Вопрос 17
Одним из важных понятий в экологии и химии является «предельно допустимая
концентрация» (ПДК). ПДК – это такое содержание вредного вещества в окружающей среде,
присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни
прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не
снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК углекислого газа в воздухе составляет 9 г/м3.
На кухне площадью 6 м2 и высотой потолка 3 м, оборудованной газовой плитой, при горении
бытового газа выделилось 180 г углекислого газа. Определите, превышает ли концентрация
углекислого газа в воздухе данного помещения значение ПДК. Предложите способ,
позволяющий снизить концентрацию углекислого газа в помещении.
Варианты ответов
- V (помещения) = 6 · 3 = 18 м3 содержание углекислого газа = 180 г / 18 = 10 г/м3 значение ПДК углекислого газа в помещении не превышает показатель 9 г/м3. замена газового оборудования на электрическое или регулярное проветривание (вентиляция) помещения не требуется
- V (помещения) = 180 · 10 = 18 м3 содержание углекислого газа = 180 г / 18 = 10 г/м3 значение ПДК углекислого газа в помещении не превышает показатель замена газового оборудования на электрическое или регулярное проветривание (вентиляция) помещения
- V (помещения) = 6 · 3 = 18 м3 содержание углекислого газа = 180 г / 18 = 10 г/м3 значение ПДК углекислого газа в помещении превышает показатель 9 г/м3. замена газового оборудования на электрическое или регулярное проветривание (вентиляция) помещения
Вопрос 18
Для изготовления глазных капель используют 3%-ный раствор иодида калия. Рассчитайте
массу иодида калия и массу воды, которые необходимы для приготовления 300 г такого
раствора. Запишите подробно ход решения задачи.
Варианты ответов
- m(иодида калия) = 300 · 3 = 900 г m(воды) = 900 – 300 = 300 г
- m(иодида калия) = 300 · 0,03 = 9 г m(воды) = 300 – 9 = 291 г
- m(иодида калия) = 300 · 3 = 900 г m(воды) = 900 = 900 г



