
Теория
электролитической
диссоциации
(ТЭД)
Тургалиева Галина Валентиновнаучитель I кв.категории
МОБУ «Карагандинская ООШ»

Задачи урока:
- Продолжить знакомство с основными
понятиями и положениями ТЭД.
2. Отработать умения характеризовать
свойства вещества на основе его строения,
составлять схемы диссоциации электролитов.
3. Отработать умения работать с интерактивной
доской.

С.А. Аррениус- шведский химик.
В 1887 году сформулировал
основные положения ТЭД.
И.А. Каблуков – русский химик.
Ввел представление
о гидратации ионов.
В.А. Кистяковский – русский
химик. Объединил ТЭД
с теорией растворов
Д.И. Менделеева.

Основные понятия ТЭД
Основные положения ТЭД

Диссоциация солей:
K 2 SO 4 →
AlCl 3 →

Диссоциация щелочей:
NaOH→
Ca(OH) 2 →

Составить схемы диссоциации кислот:
HCl →
HNO 3 →

Ступенчатая диссоциация многоосновных кислот,
кислых и основных солей :

Диссоциация по трем ступеням возможна в растворе
- Хлорида алюминия
- Нитрата алюминия
- Ортофосфата калия
- Ортофосфорной кислоты

Восстановите левую часть для схем ступенчатой диссоциации
ортофосфорной кислоты H 3 PO 4 , поставьте соответствующий знак между
левой и правой частями схемы, определите номер стадии:
… H + + HPO 4 2-
… H + + H 2 PO 4 –
… H + + PO 4 3-
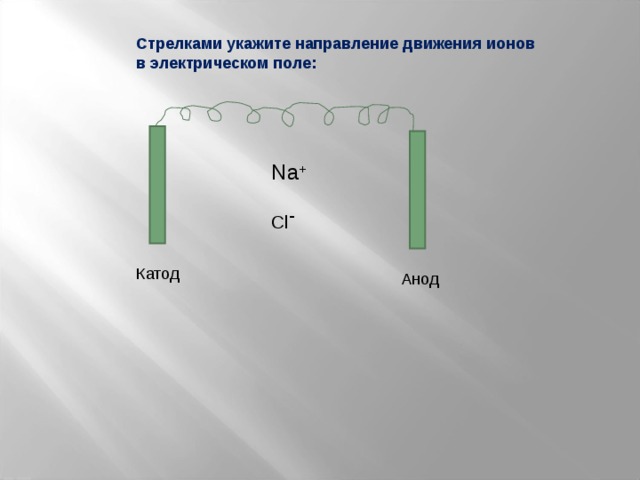
Стрелками укажите направление движения ионов
в электрическом поле:
Na +
Cl -
Катод
Анод

Что общего у изображенных веществ и
что их отличает:
2 . CH 3 COOH
3. HNO 3
4. H 2 CO 3

Составьте формулу для расчета степени диссоциации .

Основные понятия ТЭД
Основные положения ТЭД
1.Электролиты при растворении в воде или расплавлении диссоциируют на ионы.
2. В водных растворах ионы связаны с молекулами воды, т.е. гидратированы.
3. Диссоциация – обратимый процесс.
4. Ионы в электрическом поле движутся направленно: (+)-заряженные – к катоду (катионы, (-)-заряженные – к аноду (анионы).
Электролиты и неэлектролиты
Электролитическая диссоциация
Диполь, Гидратированный ион
Гидратация
Катионы и анионы
Степень ЭД
Слабые и сильные электролиты

- Ионы I - образуются при диссоциации
а) KIO 3 б) KI в) C 2 H 5 I г) NaIO 4
2 . Вещество, при диссоциации которого образуются катионы Na + , H + и SO 4 2- , является:
а) кислотой б) щелочью в) средней солью г) кислой солью
3. Электрический ток проводит
а) спиртовой раствор иода
б) расплав парафина
в) расплав ацетата натрия
г) водный раствор глюкозы
4. Электролитом является каждое вещество в ряду:
а) C 2 H 6 , Ca(OH) 2 , H 2 S , ZnSO 4
б) BaCl 2 , CH 3 OCH 3 , NaNO 3 , H 2 SO 4
в) KOH , H 3 PO 4 , MgF 2 , CH 3 COONa
г) PbCO 3 , AlBr 3 , C 12 H 22 O 11 , H 2 SO 3

Д/з: стр. 148-150 учебника О.С.Габриеляна «Химия-11»,
Всем: №2,3,4 стр.156.
*Задача :Определить количество вещества и число ионов натрия, образующихся при диссоциации 2 молей ортофосфата натрия. Считать, что степень диссоциации соли 100%.

Выбери правильное утверждение:
1. электролиты проводят электрический ток
2. источником тока в растворе электролита являются электроны
3. катионы заряжены положительно, анионы - отрицательно
4. Растворы электролитов проводят ток из-за наличия в них положительных и отрицательных ионов
5. процесс взаимодействия воды с частицами вещества называется гидратацией
6. дистиллированная вода проводит ток
7. одной из причин диссоциации веществ в воде является особое строение молекулы воды.
8. все растворимые кислоты - сильные электролиты
9. все растворимые основания и соли - сильные электролиты











































