Урок 28 11 класс 1.04.2020
Тема: Окислительные свойства серной и азотной кислот.
Задачи:
-
Систематизировать знания про окислительные свойства серной и азотной кислот
-
Повторить, как составляются уравнения химических реакций, характеризующие окислительные свойства серной и азотной кислот
Ход урока
1. Освоить параграф 39
2. Дорогие ребята, перед изучением новой темы вспомните, чем металлические свойства отличаются от неметаллических, что такое активные металлы, и какие кислоты относятся к сильным, а какие к слабым. Если у вас возникают трудности, воспользуйтесь вашим учебником или дополнительной литературой для того, чтобы дать ответы на эти вопросы.
3. Откройте свои рабочие тетради и запишите
1 марта
Домашняя работа
Окислительные свойства серной и азотной кислот
Внимательно изучите следующую информацию, после чего заполните таблицу письменно в своих тетрадях
| Химические свойства серной кислоты | Химические свойства азотной кислоты |
|
|
|
.
.
.
Окислительные свойства серной кислоты зависят от ее концентрации и типа металла, с которым она взаимодействует. Разбавленная серная кислота окисляет металлы, стоящие в ряду активности до водорода, за счет ионов Н+.
Zn + H2SO4(p) = ZnSO4 + H2
У концентрированной серной кислоты окислителем является элемент образующий кислотный остаток - SO42- , за счет атома серы в максимальной степени окисления. Окислительные свойства SO42- значительно выше, чем иона водорода Н+, поэтому концентрированная серная кислота взаимодействует практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после водорода.
Металл под действием концентрированной серной кислоты окисляется до характерной степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и степени разбавления кислоты.
Взаимодействие металлов с концентрированной серной кислотой.
При обычных условиях:
Взаимодействие активных металлов с конц. серной кислотой (Li – Zn)
8Na + 5H2SO4(k) = 4Na2SO4 + H2S + 4H2O (соль, H2S, H2O).
Взаимодействие пассивных металлов с конц. серной кислотой (Me, стоящие в ряду напряжений металлов после H2, Fe)
Cu + H2SO4(k) = CuSO4 + SO2 + H2O (соль, SO2, H2O).
Взаимодействие с неметаллами.
Окислительно-восстановительные процессы происходят и в случае нагревания некоторых неметаллов с концентрированной серной кислотой:
C + 2H2SO4(k) = CO2 + 2SO2 + 2H2O
S + H2SO4(k) = 3SO2 + 2H2O
Азотная кислота.
Самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии азотной кислоты с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
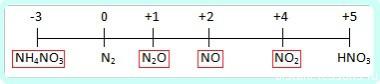
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
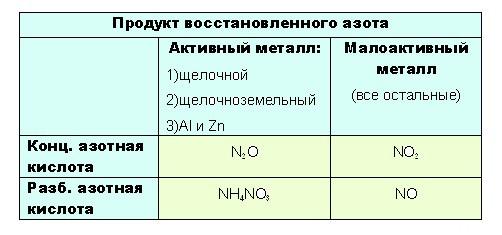
Определить какой именно продукт будет образовываться можно чисто логически: до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или NO2.
Разбавленная кислота восстанавливается глубже
при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
4. Уважаемые учащиеся, так же просмотрите параграф 39 ваших учебников, выполните письменно в тетрадях упражнения 1,2,3 на стр.183.
Пройдите в разделы Тесты и найдите категорию своего класса, решите тест «11 класс Химия1-04-2020». Для прохождения теста вам необходимо нажать на название теста, пролистать до конца открывшийся документ, нажать кнопку в конце "Пройти тест", ввести имя, фамилию и свой класс.
Выполнение теста обязательно сразу после изучения материала!




























