Периодический закон и периодическая система химических элементов Д. И. Менделеева
1. В каком периоде, в какой группе и в какой подгруппе находятся элементы с порядковыми номерами 14, 29, 52, 56, 78?
2. Напишите символ, название и порядковый номер элемента, который находится: а) в третьем периоде и в главной подгруппе шестой группы; б) в пятом периоде и в побочной подгруппе второй группы; в) в шестом периоде и в главной подгруппе четвертой группы; г) в четвертом периоде и в побочной подгруппе седьмой группы.
3. Напишите символы, названия и порядковые номера всех элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы; в) в третьем периоде.
4. Какие элементы главной подгруппы пятой группы являются элементами малых периодов? Напишите их символы, названия, порядковые номера.
5. Какое общее свойство имеют элементы главной и побочной подгрупп одной группы?
6. Напишите формулы оксидов всех элементов четвертой группы, в которых эти элементы имеют высшую валентность.
7. Напишите формулы оксидов элементов с порядковыми номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
8..Какой элемент имеет более выраженные металлические свойства: Са (Z = 20) или Ва (Z = 56)? Почему?
9. Какой элемент имеет более выраженные неметаллические свойства: Р (Z = 15) или CI (Z = 17)? Почему?
10. Какой элемент четвертого периода является самым активным неметаллом? Почему?
11. Какой элемент пятого периода является самым активным металлом? Почему?
12. Какой элемент главной подгруппы шестой группы является самым активным неметаллом? Почему?
13. В каких группах Периодической системы все элементы являются металлами?
Строение атома: физический смысл порядкового номера элемента, массовые числа атомов, изотопы
1. Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод С, сера S, медь Си, барий Ва, серебро Ag?
2. Назовите элемент, в ядре атома которого содержится 11 протонов.
3. Назовите элемент, в атоме которого содержится 26 электронов.
4. Чему равно число нейтронов в атомах следующих изотопов: 15N, 119Sn, 235U?
5. Напишите символы изотопов олова, атомы которых содержат 66, 68, 69, 71, 72 нейтрона.
6. Определите молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода — дейтерий.
7. Элемент медь существует в виде двух изотопов: 63Сu и 65Сu. Содержание в природе первого изотопа равно 73%, второго — 27%. Вычислите относительную атомную массу меди.
8. Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16?
9. Сколько электронов и протонов входит в состав атома элемента, который находится: а) в 5-м периоде и в побочной подгруппе VI группы; б) в 4-м периоде и в главной подгруппе III группы?
Строение электронной оболочки атома. Квантовые числа. Принцип Паули
1. На каком энергетическом уровне нет р-подуровня? Почему?
2. На каких энергетических уровнях нет d-подуровней? Почему?
3. Продолжите табл. 1 (см. текст) для четвертого энергетического уровня (N-уровня). Сколько орбиталей на N-уровне?
Таблица 1
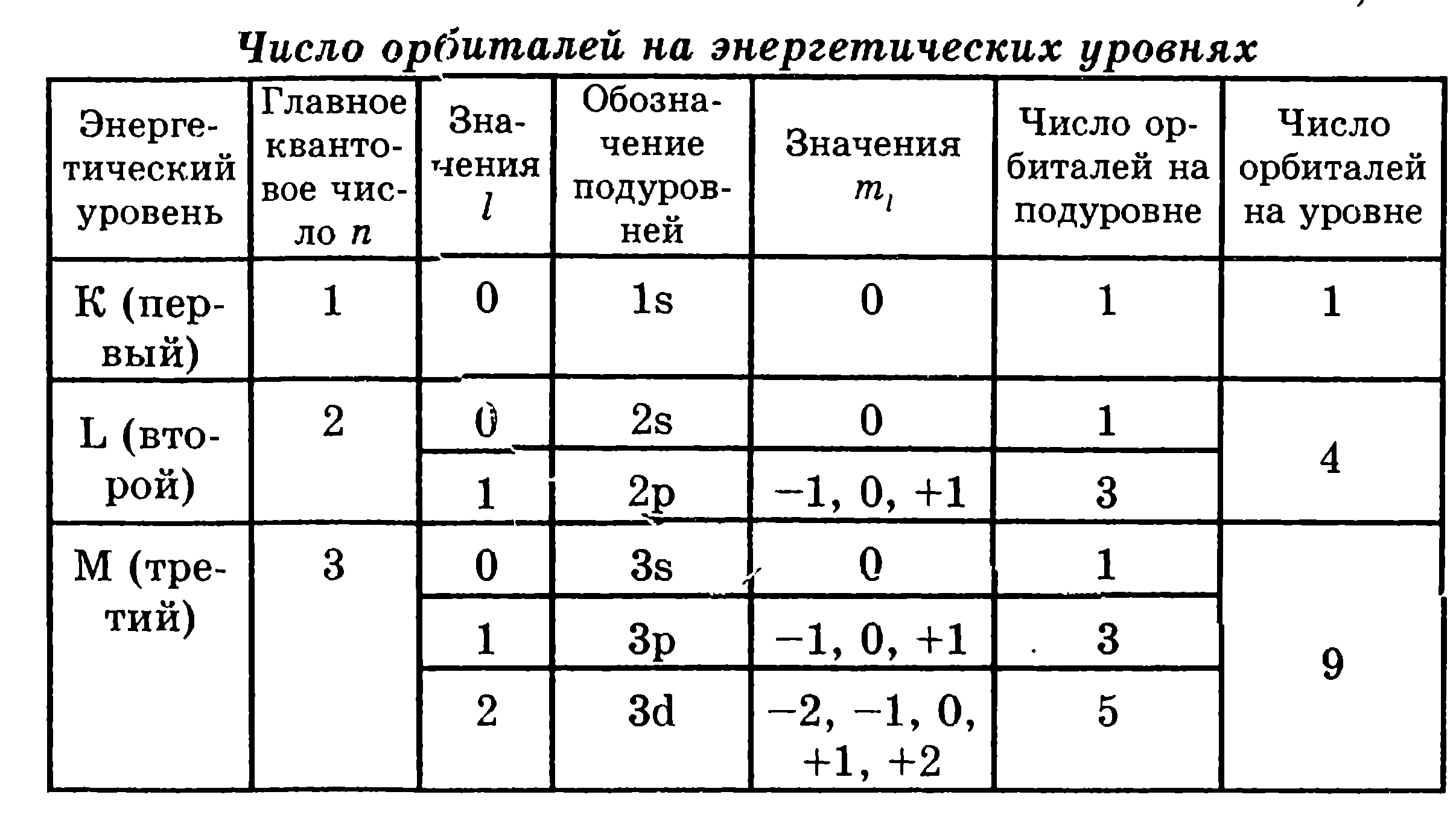
4. Продолжите табл. 2 (см. текст) для четвертого энергетического уровня (N-уровня). Чему равно максимальное число электронов на N-уровне?
Таблица 2

5. Чему равны все квантовые числа для двух электронов, которые находятся на 3s-подуровне?
6. Напишите наборы всех четырех квантовых чисел для всех электронов, которые находятся на 4р-подуровне: 
7. На каком энергетическом уровне и на каком энергетическом подуровне находится электрон, для которого n = 4 и l = 1? Какую форму имеет облако этого электрона?
8. Какие значения имеют главное квантовое число n и побочное квантовое число l для следующих подуровней: 1s, 2s, 2p, 3s, 3р, 3d, 4s, 4p, 4d, 4f?
9. Заполните таблицу:

10. Чем отличается электронное облако, которое характеризуется n = 4 и l = 0, mi = 0, от электронного облака, которое характеризуется n = 3, l = 0, mi = 0?
Строение электронной оболочки атома. Заполнение орбиталей электронами. Электронные конфигурации атомов элементов I—IV периодов




1. Используйте правило Гунда и напишите электронно-графические формулы электронных конфигураций р2, р4, d7.
2. В каком электронном слое — внешнем или предвнешнем — происходит увеличение числа электронов в атомах ряда элементов от 21Sc до 30Zn?
5. Сколько электронов находится на внешнем электронном слое в атомах ряда элементов от 21Sc до 30Zn?
6. Сколько электронов находится на внешнем электронном слое в атомах благородных газов?
Периодическая система химических элементов и электронное строение атомов
1. По положению элементов в периодической системе определите число электронных слоев и число электронов на внешнем электронном слое в атомах: а) углерода 6С; б) серы 16S; в) цезия 55Cs; г) кальция 20Ca; д) висмута 83Bi; e) йода 53I; ж) ксенона 54Хе. Напишите для каждого из этих элементов электронную и электронно-графическую формулы внешнего электронного слоя.
2. Укажите, к какому электронному семейству относится каждый из следующих элементов: а) 6С; б) 56Ва; в) 41Nb; r)35Br; д) 37Rb; е) 26Fe; ж) 17Cl. Какой подуровень заполняется последним в атомах этих элементов?
3. По электронной формуле внешнего электронного слоя атома определите, какой это элемент. Напишите его название, символ и порядковый номер: a) 3s23p4; б) 4s24p6; B)2s22p1, г) 5s25p3; д) 6s26p2; e) 5s25p2; ж) 3s23p3. К какому электронному семейству относится каждый из этих элементов?
4. Чему равно общее число s-элементов в периодической системе? Напишите символы и порядковые номера всех s-элементов.
5. Атомы каких трех элементов имеют структуру внешнего электронного слоя 4s1? Напишите их символы и названия. К каким электронным семействам они относятся? Чем отличаются они по электронному строению?
6. У какого элемента начинает заполняться 3d-подуровень? Сколько электронов на внешнем слое атома этого элемента? У какого элемента заканчивается заполнение 3d-подуровня? Сколько электронов на внешнем слое атома этого элемента?
7. У какого элемента начинается заполнение 4p-подуровня и у какого элемента заканчивается?
8. Определите положение элементов в периодической системе (период, группа, подгруппа) по электронным формулам:
а) ls22s22p63s23p4;
б) ls22s22p63s23p64s23d5 (или ls22s22p63s23p63d54s2);
в) ls22s22p63s23p64s23d10 (или ls22s22p63s23p63d104s2);
г) ls22s22p1;
д) ls22s22p63s1;
е) ls22s22p63s23p64s23d104p5 (или ls22s22p63s23p63d104s24p5);
ж) ls22s1.
Модель решения задания 8

В атоме три электронных слоя, значит, элемент находится в III периоде.
Последним в атоме заполняется s-подуровень, следовательно, это элемент главной подгруппы. На внешнем электронном слое атома находятся два электрона, поэтому это элемент II группы магний Mg.






















