Тема урока: «Железо и его соединения»
Класс: 9 класс
Цели урока:
Образовательная:
Расширить знания учащихся о химическом элементе и простом веществе – железе, о его физических свойствах, опираясь на знания зависимости свойств металлов от строения их атомов;
Рассмотреть химические свойства железа; сформировать понятия о составе и свойствах оксидов и гидроксидов железа;
Познакомить учащихся с качественными реакциями на катионы железа (двух- и трехзарядные);
Расширить и углубить знания о нахождении железа в природе, получении.
Развивающая:
Развивать у учащихся способности анализировать, выделять главное, обобщать и делать выводы;
Прививать навыки поисковой и самостоятельной работы;
Продолжить работу над формированием навыков по применению знаний при решении теоретических и практических задач (формирование предметной компетентности).
Воспитательная:
Содействовать в ходе урока формированию научного мировоззрения, коммуникативной и информационной компетенции.
Воспитание интереса к предмету.
Тип урока: Урок усвоения новых знаний. Первичное закрепление новых знаний.
Оборудование: Учебник О.С.Габриеляна, компьютер, ПСХЭ Д.И. Менделеева, мультимедийная презентация.
Методы: словесный, объяснительно – иллюстративный, беседа, проблемный.
Форма организации учебной деятельности обучающихся: фронтальная. Урок с элементами технологии критического мышления.
Ход урока
Организационный момент
Приветствие. Проверка готовности к уроку.
Актуализация имеющихся знаний
Стадия "Вызов". На этой фазе происходит актуализация знаний, имеющихся у учащихся, возникает интерес к обсуждаемому вопросу.
Задание: « Перевертыши». Вам необходимо решить анаграммы, найдя закономерность исключить лишнее.
|
| Правильные варианты |
| зоат | Азот |
| имийекр | Кремний |
| езжозел | Железо |
| леруогд | Углерод |
| роагн | Аргон |
Железо ( остальные элементы – неметаллы)
- Какова же тема урока? Железо и его соединения.
Железо в переводе шумерского языка – это металл, «капнувший с неба, небесный». Первое железо, с которым столкнулось человечество, было железо метеоритов. Впервые доказал, что «железные камни падают с неба», в 1775 году русский ученый П.С.Палас, который привез в Петербург глыбу самородного железного метеорита весом 600 кг. Самым крупным железным метеоритом является найденный в 1920 году в Юго-Западной Африке метеорит «Гоба» весом около 60 тонн.
Хотя железный век закончился, однако, значение железа нисколько не уменьшилось в жизни человека. И поэтому начать наш урок хотелось бы со слов великого русского академика Ферсмана:
«Железо не только основа всего мира, самый главный металл окружающей нас природы, оно основа культуры и промышленности, оно орудие войны и мирного труда. И трудно во всей таблице Менделеева найти и другой такой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества».
Расчертите листок вашей тетради на 3 части и подпишите графы.
| Я знал | Хочу узнать | Что узнал |
Заполните первые 2 графы, а третью заполните по окончанию урока.
- На сегодняшнем уроке Вы познакомитесь с элементом побочной подгруппы – железом: его строением атома, физическими и химическими свойствами, нахождением в природе, получением, а также значением железа в природе и жизни человека. По ходу изучения вы будете заполнять путевые листы (Приложение 1), указывающие вам путь. Обратите внимание, что в путевом листе есть задания помеченные звездочкой их мы выполним в конце урока.
III. Усвоение нового материала.
- Охарактеризуйте химический элемент железо по его положению в ПСХЭ Д. И. Менделеева и особенности строения атома.
Положение в ПС
1)Химический знак Fe, Аґ – 56
2) Период - большой
3) Группа VIII, побочной подгруппы
Проблема: Вам известно, что у элементов периодической системы Д.И. Менделеева число электронов на последнем энергетическом уровне определяется по номеру группы. Почему железо, находящееся в VIII группе IV периода на последнем энергетическом уровне имеет 2 электрона?
Строение атома.
Учитель вызывает к доске одного ученика для написания электронной формулы железа.
Железо – элемент побочной подгруппы VIII группы и IV периода Периодической системы Д.И.Менделеева. Атом железа устроен несколько отлично от атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра уровень. На последнем уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково:
Заряд ядра атома +26, число энергетических уровней = 4.
Электронная формула + 26 Fe )2)8)14)2
1s2 2s22p6 3s23p6 3d61s2 4s2
- Какие свойства (окислительные или восстановительные) проявляют атомы железа?
Восстановительные
Fe0 – 2e = Fe+2
Fe0 – 3e = Fe+3
- Какие степени окисления при этом будет проявлять железо?
+ 2,+ 3
Часто при химических взаимодействиях атомы железа отдают не только 2 электрона с внешнего уровня, но и один электрон с предпоследнего уровня, при степень окисления повышается до +3.
Физические свойства железа.
Железо – металл. Каковы его физические свойства?
Серебристо-серый Ме
Ковкий (латинское название железа Ferrum означает «крепость»)
Очень пластичный (поэтому легко обрабатывается прокатывается штампуется куётся)
Плотность 7.87 г/см3
Высокая температура плавления (1539 ⁰С)
Проводит тепло и электричество
Обладает магнитными свойствами
Способен образовывать сплавы
Сталь и чугун представляют собой сплавы железа с углеродом Сплавы содержащие до 2% «С» называют стали а свыше 2% «С» - чугунами
- Различают железо: химически чистое (
- Как человек использует физические свойства железа?
Это основа современной техники и сельскохозяйственного машиностроения. Транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Химические свойства железа
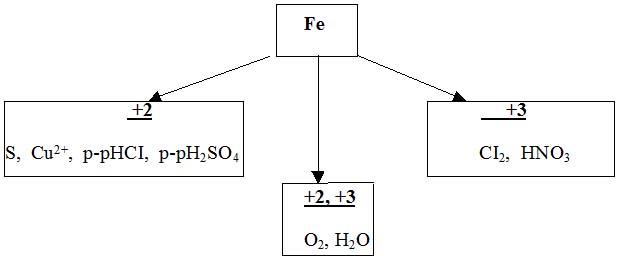
- Переходя к описанию химических свойств железа, еще раз повторим, что оно может проявлять степени окисления +2 и +3, следовательно, железо дает два ряда соединений.
Степень окисления железа зависит от окислительной способности реагирующего с ним вещества.
При взаимодействии с сильными окислителями (галогены и О2) железо принимает степень окисления +3, с более слабыми - +2.
Взаимодействие с простыми веществами (неметаллами)
С галогенами железо образует галогениды, в которых оно имеет степень окисления +3.
2Fe+3CI2 = 2FeCI3
Fe + S = FeS
3Fe+2O2 = Fe3O4(FeO•Fe2O3)
Взаимодействие со сложными веществами
В разбавленных соляной и серной кислотах железо растворяется, окисляясь ионами водорода, при этом образуются соли железа (II) и водород:
Fe + 2HCl = FeCl2+ H2↑,
Fe + H2SO4разб. = FeSO4 + H2↑,
Растворяется железо и в разбавленной азотной кислоте, при этом образуется нитрат железа(III), вода и продукт восстановления азотной кислоты – N2, NO или NH3 (NH4NO3) в зависимости от концентрации кислоты.
Fe + 4HNO3разб. = Fe(NO3)3 + NO↑ + 2H2O
Концентрированные H2SO4 и HNO3 пассивируют железо, образуя на поверхности металла плотную прочную оксидную пленку.
В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него из водных растворов их солей.
Fe + CuSO4 = Cu + FeSO4
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре (700-900 ⁰С) железо реагирует с водой:
3Fe+4H2O = 4H2↑+Fe3O4;
Если условия обычные и присутствует кислород, то железо корродирует:
4Fe+ 4H2O+ 3O2 = 4Fe(OH)3рж.
Вывод:
Соединения железа

Оксид и гидроксид железа (II) имеют ярко выраженные основные свойства.
Соединения железа(II) неустойчивы, они могут они могут легко окисляться (например, кислородом воздуха пероксидом водорода или другими окислителями) и переходить в соединения железа(III).
Fe+2Cl2 + Cl2 = Fe+3Cl3
Fe+2(OH) + H2O + O2 = Fe+3(OH)3
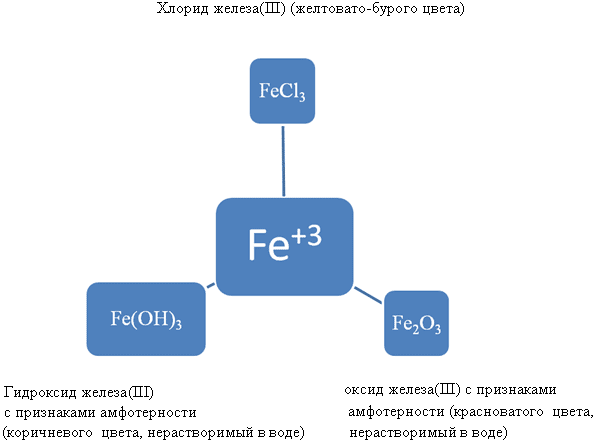
Оксид и гидроксид железа (II) а также оксид и гидроксид железа (III) получают косвенным путем, т.е. в природе в чистом виде они не существуют.
Их можно получить по следующим цепочкам превращения:
Fe → FeCl2 → Fe(OH)2 → FeO
Fe → FeCl3 → Fe(OH)3 → Fe2O3
- Решите данные цепочки в своих путеводных листах.
Для распознавания соединений железа (II) и железа (III) проводят качественные реакции на ионы Fe+2 и Fe+3
Также качественной реакцией на Fe+2 служит реакция солей железа(II) с веществом, называемым красной кровяной солью K3[Fe(CN)6] – это комплексное соединение. (Демонстрация видеоролика)
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4.
Образуется темно-синий осадок (турнбулева синь).
А качественной реакцией на Fe+3 служит реакция солей железа(III) с комплексным соединением – желтая кровяная соль, роданидом калия KCNS или роданидом аммония NH4CNS. (Демонстрация видеоролика)
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl.
Образуется темно-синий осадок (берлинская лазурь).
FeCl3+ 3KCNS = Fe(CNS)3 + 3KCl.
Образуется роданид железа(III) темно-красного цвета
- А теперь рассмотрим вопрос о природных соединениях железа.
Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила советская автоматическая станция «Луна», обнаружено железо в неокисленном состоянии.
У вас на столах имеется дополнительный материал по этому вопросу. Вашим заданием будет, прочитав данный текст (Приложение 2) заполнить таблицу в ваших путеводителях
IV. Закрепление изученного материала
- Вернёмся к путевому листу. Выполните задания, помеченные звездочкой.
- Объясните такой интересный факт.
«Близ города Дели в Индии стоит железная колонна без малейшего пятнышка ржавчины, хотя ей почти 2800 лет. Это знаменитая Кутубская колонна высотой 7 м. и массой 6,5 т. Надпись на колонне говорит о том, что она была поставлена в 9 веке до н. э.»
Чем объяснить её долговечность и коррозийную стойкость?
Ответ: колонна была изготовлена из чистого металла: железа в колонне оказалось 99,72 %, то есть, оно химически чистое. Как удалось получить такой чистый металл в то время до сих пор загадка.
Стадия «Рефлексия»
- Заполните третью колонку таблицы «Знаю - хочу узнать - узнал».
V. Домашнее задание
1) §14, учебник стр.76-81
2) Заполните схему о применении соединений железа 
Приложение 1.
Путевой лист
| Fe–химический элемент: |
| Положение в периодической системе. |
|
| Строение атома. |
|
| Степень окисления. |
|
| Элек. формула атома Fe |
|
| *Элек. формула иона Fe2+ |
|
| *Элек. формула иона Fe3+ |
|
| Fe–простое вещество: |
| Физические св-ва.
|
|
|   Различают железо Различают железо
Химически чистое Технически чистое |
| Химические св-ва |
| А) С простыми веществами (окислителями) | Fe + CI2= Fe + O2 = Fe + S = |
| Б) С водой
| Укажите условия реакций
Fe + H2O = Fe + H2O + O2 = |
| В) С кислотами

Холодные концентрированные H2SO4 и HNO3  пассивируют железо пассивируют железо
| Fe + HCl =
Fe + H2SO4разб. =
t0 2Fe0 + 6H2S+6O4конц. = Fe2(SO4)3 = 3S+4O2↑ + 6H2O t0 Fe0 + 6HN+5O3конц. = Fe+3(NO3)3 + 3N+4O2↑ + 3H2O
Fe + HNO3разб. =
|
| Е) С солями (см. электрохимический ряд напряжений металлов) | Fe + CuSO4 =
|
| Вывод: 
|
| Соединения железа |
| Соединения железа (II) |
|
| Соединения железа (III) |
|
| Fe → FeCl2 → Fe(OH)2 → FeO 1 2 3 | Fe → FeCl3 → Fe(OH)3 → Fe2O3 1 2 3 |
| Качественные реакции на ионы Fe3+
|
|
| Качественные реакции на ионы Fe2+
|
|
| Важнейшие природные соединения железа | Название минерала | Химическая формула | Содержание железа
(в %) | Важнейшие месторождения | Применение | | Магнитный железняк
(магнетит) |
|
|
|
| | Красный железняк
(гематит) |
|
|
|
| | Бурый железняк
(лимонит) |
|
| . |
| | Шпатовый железняк
(сидерит) |
|
|
|
| | Серный колчедан
(пирит) |
|
|
|
|
|
Приложение 2
Текст.
Железо сыграло большую роль в развитии человеческого общества и не потеряло своего значения в настоящее время. Из всех металлов оно наиболее широко используется в современной промышленности.
Первобытный человек начал использовать железные орудия труда за несколько тысячелетий до нашей эры. В те годы единственным источником этого металла были упавшие на землю метеориты, которые содержат довольно чистое железо. В середине 2-го тысячелетия до н. э. в Египте была освоена металлургия железа – получение его из железных руд. Это событие стало началом железного века в истории человечества, который пришел на смену каменному и бронзовому векам.
Основными железными рудами являются:
– Магнетит Fe3O4 – содержит 72% железа. Данный минерал дал название магниту, магнитному полю и всему загадочному явлению магнетизма, которое пристально изучается со времен Аристотеля и по сей день.
Магнитные свойства этого минерала и сегодня используются, прежде всего для поиска месторождений. Именно так были открыты уникальные месторождения железа на площади Курской магнитной аномалии (КМА). Минерал тяжелый: образец магнетита размером с яблоко весит 1,5 кг. Месторождения магнетита встречаются на Южном Урале, Курской магнитной аномалии.
– Гематит Fe2O3 – содержит до 65% железа, такие месторождения железа встречаются в Криворожском районе. Важной особенностью минерала является способность стойко хранить цвет и передавать его другим минералам, в которые попадает хотя бы небольшая примесь гематита. Розовый цвет гранитных колонн Исаакиевского собора – это цвет полевых шпатов, которые в свою очередь окрашены тонкораспыленным гематитом.
– Лимонит Fe2O3•nH2O – содержит до 60% железа, месторождения лимонита встречаются в Крыму, например керченское месторождение.
– Пирит FeS2 – содержит примерно 47% железа. Свое название этот минерал получил от греческого слова "пирос" – огонь, что связано с его свойством искрить при ударе стальными предметами. Пирит — основное сырье для получения серной кислоты. Кроме того, из него извлекаются примеси: золото, медь, серебро, кобальт, никель и другие элементы. Пирит обладает способностью осаждать золото из растворов. На этом основано использование его для добычи золота, содержащегося в морской воде. Месторождения пирита встречаются на Урале.
В некоторых местах встречается минерал сидерит, основная составная часть которого - карбонат железа(II) FеCO3. Содержит в себе примерно 35% железа. Его тоже используют для производства чугуна и стали. В России имеются месторождения сидерита на Урале (Бакальское). Изредка встречается и метеоритное (почти чистое) железо.
В водах многих минеральных источников содержатся гидрокарбонат железа Fе(HCO3)2 и некоторые другие соли железа. Из курса биологии нам известно, что железо имеет большое значение в живой природе. Оно является важной составной частью гемоглобина крови.












 Различают железо
Различают железо 











