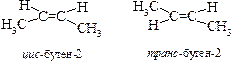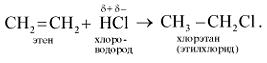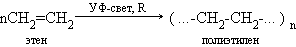Тема урока: Непредельные углеводороды ряда этилена.
«О, сколько нам
открытий чудных
готовит просвещенья дух…»
А.С.Пушкин
Цель урока: Познакомить учащихся с классом непредельных углеводородов - алкенами. Изучить свойства, получение и применение алкенов на примере этилена.
Задачи урока:
Образовательная: Продолжить формирование у учащихся умение устанавливать причинно-следственные связи между строением, химическими свойствами и на этой основе применением алкенов и их производных, формирование научного мировоззрения.
Развивающая: Совершенствовать навыки в составлении уравнений химических реакций. На основе повторения ранее изученного материала и в ходе изучения нового углубить умение высказывать свою точку зрения, делать выводы.
Воспитательная: Воспитание патриотизма, чувства уверенности в своих силах, способствовать развитию коммуникабельности и объективной самооценки.
Оборудование: образцы изделий из полиэтилена
Ход урока
Организационный этап
Целеполагание и мотивация.
Беседа по вопросам.
- какой предмет мы начали изучать?
- какие углеводороды называются предельными?
- Почему углеводороды ряда метана называются насыщенными или предельными
- Какие вещества называются гомологами
- Что такое гомологический ряд
- Какие соединения называются изомерами
- Опишите физические свойства алканов
- Перечислите основные химические свойства алканов
III. Актуализация знаний учащихся
У меня на столе шаростержневые модели двух веществ. Сравните их между собой, найдите сходства и отличия.
Перед вами модели молекул этилена и этана Между атомами С существует двойная связь. Подобно метану, этилен образует свой гомологический ряд и является его первым членом. Общая формула этиленовых углеводородов CnH2n.
IV. Формирование новых знаний
1.определение
Алкены – ненасыщенные углеводороды с общей формулой СnH2n , в молекулах которых имеется одна двойная связь.
Простейший представителем алкенов является этилен С2Н4. Поскольку гомологический ряд алкенов начинается с этилена, их и называют углеводородами ряда этилена. Раньше этиленовые углеводороды (алкены – по систематической номенклатуре ИЮПАК) называли также олефинами.
Название составляют аналогично алканам с заменой суффикса -ан на -ен и указанием после него локанта двойной связи. Например:
Радикалы алкенов называются аналогично радикалам алканов: СН2=СН – этенил(винил).
2. Строение алкенов. 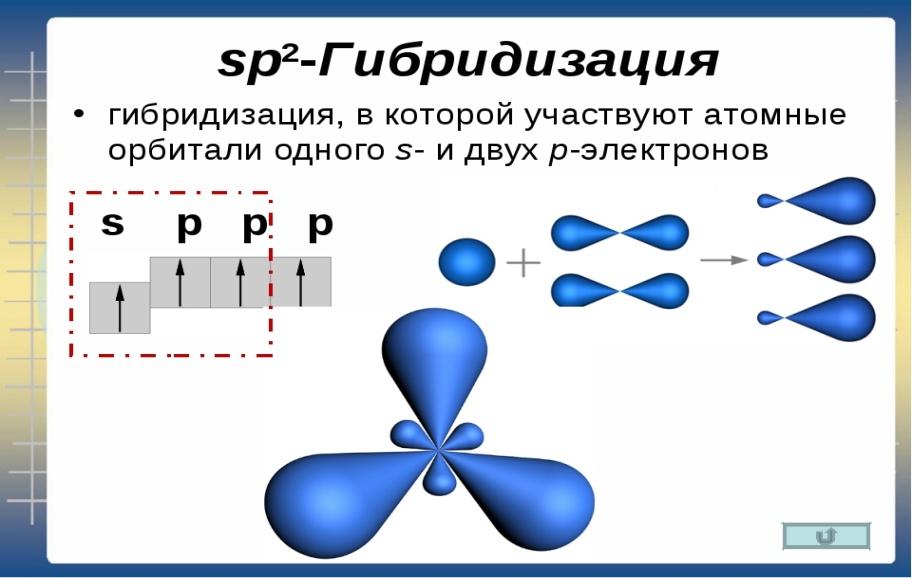
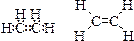
В молекуле алкена ненасыщенные атомы углерода находятся в sp2-гибридизации, а двойная связь между ними образована σ– и π-связью. sp2-Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р-орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
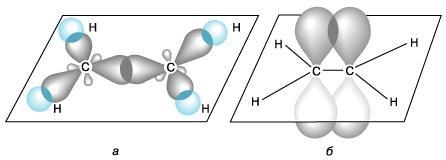
Пространственное строение этилена:
В результате образования молекулы этилена образуетяс 5σ-связей и одна π-связь, которая в пространстве располагается перпендикулярно σ-связям.
Как образована двойная связь?
-Двойная связь образована одной σ-связью и одной π-связью.
Какая связь более прочная?
-Более прочная σ-связь.
Длина связи С=С 0,134 нм, энергия связи С=С Ес=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль.
3. изомерия
Для алкенов характерно несколько видов изомерии.
1. У алкенов, как и у алканов, изомерия обусловлена строением углеродного скелета. Например, изомеры бутена (С4Н8):
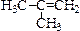 2-метилпропен-1
2-метилпропен-1
СН2=СН-СН2 - СН3 бутен-1
2. Изомерия, связанная с положением двойной связи.
В зависимости от положения двойной связи молекула бутена имеет два изомера. Двойная связь может находиться у концевого углерода или у срединного атома углерода:
СН2=СН-СН2 - СН3 бутен-1
СН3 - СН=СНСН3 бутен-2
3. Межклассовая изомерия.
Общая формула алкенов и циклоалканов одинакова CnH2n. Согласно межклассовой изомерии, изомеры бутена С4Н8 – циклобутан и метилциклопропан:

 СН2
СН2
![]() Н2С СН-СН3
Н2С СН-СН3
4. Пространственная изомерия (цис и транс).Геометрическая изомерия
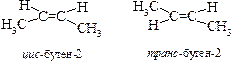
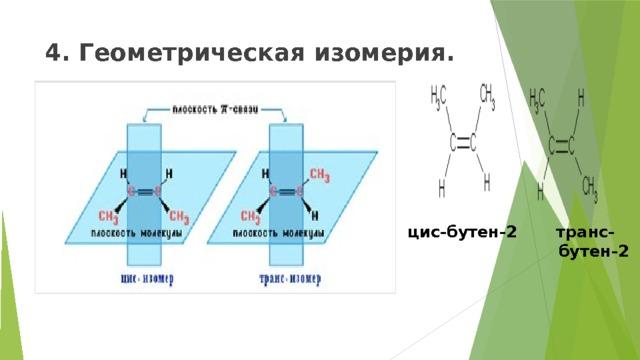
Если одинаковые заместители СН3 в изомере находятся по одну сторону плоскости двойной связи, то образуется цис – изомер, если находятся по разные стороны-транс –изомер.Эти изомеры обладают различными физическими и химическими свойствами. Транс-изомер является более устойчивым, чем цис-изомер.
Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами. Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия. Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
4. номенклатура
По систематической номенклатуре названия алкенов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например: (слайд 11)
СH3
|
H3C—CH2—C—CH==CH2 H3C—C==CH—CH—CH2—CH3
| | |
CH3 CH3 CH3
3,3-диметилпентен-1 2,4-диметилгексен-2
5. Физические свойства.
Первые три представителя гомологического ряда этиленовых углеводородов – газы, начиная с С5Н10 – жидкости, а С18Н36 и высшие алкены – твердые вещества. С увеличением молекулярной массы алкена повышается их температуры плавления и кипения. Алкены с углеродной цепью нормального строения кипят при более высокой температуре, чем их изомеры, которые имеют разветвленную структуру. Перемещение двойной связи в центр молекулы вызывает повышение температур кипения и плавления алкена.
С2H4 до C4H8 - газы
C5 H10 до C18H36 - жидкости
C19H38 и т.д. – твердые вещества.
С ростом числа атомов углерода возрастает tкип, tпл и плотность. Все алкены плохо растворяются в воде

6. Химические свойства.
Химические свойства алкенов обусловлены в первую очередь присутствием в их молекулах двойной углерод-углеродной связи С=С. Так как двойная связь легко разрывается, алкены способны присоединять атомы других элементов. В связи с этим алкены вступают в реакции:
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из 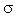 - и
- и  -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва
-связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва  -связи.
-связи.
Способность к реакциям присоединения характерна для всех алкенов.
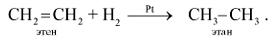
1. Присоединение водорода (реакция гидрирования):
2. Присоединение галогенов (реакция галогенирования):
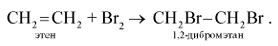
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):
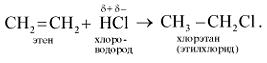
Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
5.Полимеризация (Процесс соединения одинаковых молекул в более крупную молекулу):
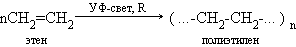
В результате реакции образуются полимеры .Поли- много (греч.)
Алкены так же горят в кислороде коптящим пламенем, что объясняется их непредельным характером.
С2Н4 + 3О2 2СО2↑+ 2Н2О
2СО2↑+ 2Н2О
При действии на этилен водного раствора КМnO4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля:
3H2C=CH2 + 2KMnO4 + 4H2O → 3HOCH2—CH2OH + 2MnO2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
6. Получение этилена.
Алкены в промышленности получают путём отщепления водорода в молекулах соответствующих алканов.
С2Н6 С2Н4+ Н2↑
С2Н4+ Н2↑
Реакции разложения углеводородов, протекающие с выделением водорода, называют реакцией дегидрирования.
7. Применение:
1.Этилен используют в медицине для общего наркоза при операциях.
2.Сырьё для производства полимеров.
3.Производство этилового спирта
4.Производство уксусной кислоты, антифризов.
5.Этилен используют в теплицах и на складах хранения овощей и фруктов для ускорения созревания плодов.
V. Итог урока:
Дописать предложения:
1.В молекуле этилена есть... (одна двойная связь).
2.В отличие от этана этилен вступает в реакцию ... (присоединения).
3.Полиэтилен –это полимер, который содержит... ( большое количество молекул этилена).
4.Этилен получают из... (этана). Эту реакцию называют реакцией... (дигидрирования).
VI. Выводы по уроку:
Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Общая формула – СnH2n. В названии алкенов используется суффикс –ен.
Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами.
Алкены обладают большой химической активностью. За счёт наличия кратной связи алкены вступают в реакции присоединения, окисления, полимеризации.
VII. Домашнее задание: § 39.







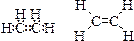

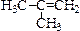 2-метилпропен-1
2-метилпропен-1
 СН2
СН2