
Периодический закон и периодическая система химических элементов Д. И. Менделеева
Преподаватель Звягинцева О.В.

Периодический закон и периодическая система химических элементов Д. И. Менделеева
Преподаватель Звягинцева О.В.

Предпосылки открытия Периодического закона

«Система – это ариаднина нить, без нее все дело превращается в хаос».
Карл Линней
«Называть, описывать и классифицировать – вот основа и цель науки».
Кювье

1. Накопление фактологического материала
- Химикам 60-х гг. XIX века были известны 63 элемента. Подробно были описаны свойства каждого из них и их соединений, многие имели широкое промышленное значение, ученые находили между ними черты определенного сходства и разительного отличия. Появилась нужда в систематизации элементов.

2. Работы предшественников Д.И.Менделеева
- Таблица простых тел Лавуазье
- Классификация Берцелиуса
- Триады Деберейнера
- Спираль Шанкуртуа
- Закон октав Ньюлендса
- Таблица Мейера

1787 г. Таблица простых тел Лавуазье
Первая попытка привести элементы в какую-то систему относится еще к тому времени, когда классическая химия только становилась на ноги. Она принадлежит Лавуазье. Он составил таблицу простых тел, основанную на классификации их по химическим свойствам. Сейчас эта таблица вызывает к себе лишь исторический интерес, но в свое время она сыграла важную роль.
Антуан Лоран Лавуазье
(1743 – 1794)

Начало XIX в. Классификация Берцелиуса
Выдающийся шведский химик Берцелиус предложил деление на металлы и неметаллы на основании свойств. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам - кислотные оксиды и кислоты .
Классификация не потеряла актуальность и в наши дни.
Берцелиус Йенс-Якоб
(1779 – 1848)

1829 г Триады Дёберейнера
Дёберейнер распределил сходные по свойствам элементы по три (триады). Обнаружил закономерность: масса атома среднего элемента в триаде равна среднеарифметической величине из масс атомов крайних
Иоганн Вольфганг
Дёберейнер
(1780 – 1849)
Li
7
Na
K
(7+39):2=23
39

1862 г «Земная спираль» Шанкуртуа
Шанкуртуа расположил элементы по спирали в порядке возрастания их атомных масс. Заметил сходство свойств образуемых элементами веществ, попадающих на одну вертикальную линию цилиндра.
Александр Эмиль Бегуйе де Шанкуртуа
(1820-1886)

1864 г. «Закон октав» Ньюлендса
Английский химик Д. Ньюлендс, располагая элементы последовательно в порядке возрастания их атомных масс, заметил, что восьмой по счету элемент повторяет свойство первого, подобно повторению звуков в музыкальной октаве и назвал свою таблицу «законом октав»:
Джон Александр
Рейна Ньюлендс
(1837-1898)
H
F
Li
Be
Cl
Na
Mg
B
K
Al
C
Ca
Si
Cr
N
Ti
O
P
S
Mn
Fe

1864 г Таблица Мейера
Немецкий исследователь Л . Мейер опубликовал таблицу из 28 элементов, группируя их по валентности.
Он ограничил число элементов, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов
Таблица 1870 г. состояла из девяти столбцов
Некоторые ячейки таблицы Мейер оставил незаполненными
Юлиус Лотар Мейер
(1830-1895)
Таблица Мейера 1864 г. (фрагмент)

Многие ученые пытались выявить взаимосвязь между атомными массами элементов и химическими свойствами соответствующих простых и сложных веществ. Но создать классификацию, включающую все известные в то время химические элементы, не удалось никому. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов, выявляющей природу их сходства и различия, имеющей предсказательный характер.
Открытие Периодического закона и создание Периодической системы элементов — заслуга великого русского ученого Дмитрия Ивановича Менделеева.

3. Международный конгресс химиков в г.Карлсруэ (Германия, 1860 г.)
Результатом съезда химиков в Карлсруэ стало утверждение атомно-молекулярного учения, были определены понятия атомного веса (в современной терминологии – «относительная атомная масса»), а также молекулы и атома. Было установлено, что молекула — это наименьшее количество вещества, вступающее в реакции и определяющее физические свойства, а атом — наименьшее количество элемента, содержащееся в молекулах.

Открытие Периодического закона Д.И.Менделеевым

В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях.
В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.

ОСНОВНЫЕ ПОЛОЖЕНИЯ ЗАКОНА:
1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств;
2. Сходные по свойствам элементы имеют или близкие атомные веса (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (K, Rb, Cs);
3. Сопоставление элементов или их групп по величине атомного веса отвечает их т.н. валентности;
4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами;
5. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента;
6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65-75.

Первая таблица Менделеева (1869).
H = 1
Be = 9.4
Ti = 50 V = 51 Cr = 52 Mn = 55 Fe = 56 Co = Ni = 59 Cu = 63.4
Mg = 24
B = 11
Zr = 90 Nb = 94 Mo = 96 Rh = 104.4 Ru = 104.4 Pd = 106.6 Ag = 108
Zn = 65.2
C = 12
Al = 27.4
Cd = 112
? = 68
Si = 28
? = 180 Ta = 182 W = 186 Pt = 197.4 Ir = 198 Os = 199 Hg = 200
N = 14
Ur = 116
? = 70
P = 31
O = 16
Au = 197
Sn = 118
Li = 7
F = 19
S = 32
As = 75
Se = 79.4
Sb = 122
Cl = 35.5
Na = 23
Te = 128?
Bi = 210
Br = 80
K = 39 Ca = 40 ? = 45 ?Er = 56 ?Yt = 60 ?In = 75.6
J = 127
Rb = 85.4 Sr = 87.6 Ce = 92 La = 94 Di = 95 Th = 118?
Cs = 133 Ba = 137
Tl = 204 Pb = 207

В конце 1870 г. Менделеев доложил Русскому химическому обществу статью " Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).

В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса»

В 1871 г Менделеев придал своей периодической таблице классический вид (т.н. короткая таблица).

Поскольку Менделеев и Мейер независимо друг от друга предложили весьма близкие варианты таблицы, используемое в некоторых странах название "таблица Менделеева-Мейера" можно считать не лишённым оснований.
Лондонское королевское общество в 1882 г. присудило золотые медали имени Дэви совместно Менделееву и Мейеру с формулировкой "За открытие периодических соотношений атомных весов".

Менделеев на основании предположения , что атомная масса предопределяет свойства элемента, решился изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых еще элементов.
« Ни де Шанкуртуа, которому французы приписывают право на открытие периодического закона, ни Ньюлендс, которого выставляют англичане, ни Л. Мейер, которого цитировали иные как основателя периодического закона, не рисковали предугадывать свойства неоткрытых элементов, изменять принятые веса атомов и вообще считать периодический закон новым, строго поставленным законом природы, могущим охватывать ещё доселе необобщённые факты, как это сделано мною с самого начала (1869)« »

Развитие периодического закона
Формулировка Менделеевым периодического закона и построение периодической таблицы означали лишь начало развития учения о периодичности свойств элементов.
Таблица Менделеева 1869 г. – лишь одна из множества существующих систем элементов
В развитии периодического закона принято выделять два этапа – химический и физический .
Химический этап развития периодического закона начался с открытия предсказанных элементов

В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий.
Причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её.
Поль Эмиль
Лекок де Буабодра
(1838-1912)

В 1879 г. шведский химик Ларс Фредерик Нильсон опубликовал сообщение об открытии скандия
. Свойства скандия в точности соответствовали свойствам менделеевского экабора.
Ларс Фредерик Нильсон
(1840-1899)

В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий.
Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием Менделеева .
Клеменс Александр
Винклер
(1838-1904)
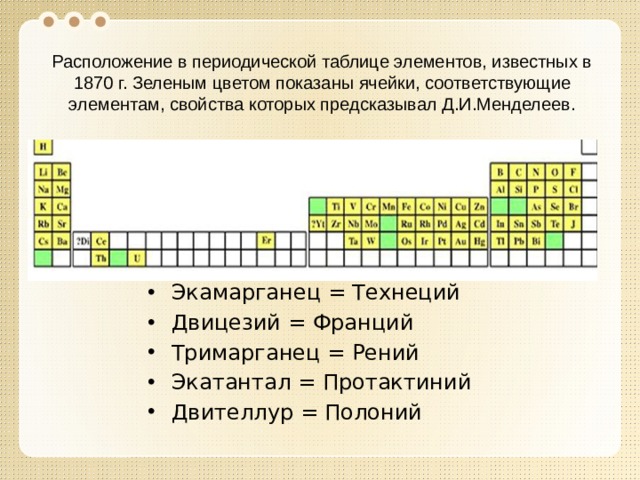
Расположение в периодической таблице элементов, известных в 1870 г. Зеленым цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д.И.Менделеев.
- Экамарганец = Технеций
- Двицезий = Франций
- Тримарганец = Рений
- Экатантал = Протактиний
- Двителлур = Полоний

Модернизация периодической таблицы
В 1900-1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы.
Менделеев и Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы.
Уильям Рамзаи
(1852-1916)̆
Инертный газ - элемент, переходный между галогенами и щелочными металлами.

Браунер предложил решение проблемы размещения в периодической таблице редкоземельных элементов.
РЗЭ составляют особую группу периодической системы:
"Подобно тому, как в Солнечной системе целая группа астероидов занимает полосу на месте пути, по которому должна бы двигаться одна планета, так точно целая группа элементов редких земель могла бы занять в системе одно место, на котором в другом случае стоит один элемент... Таким образом, все эти элементы, очень подобные один другому, стали бы на том месте в IV группе восьмого ряда, которое до сих пор занимал церий...."
Шестой период таблицы, таким образом, должен быть длиннее, чем четвёртый и пятый, которые в свою очередь длиннее, чем второй и третий периоды. В коротком варианте периодической таблицы Браунер предложил поместить все РЗЭ в одну клетку четвёртой группы.
Богуслав Браунер
(1855 – 1935 г.)
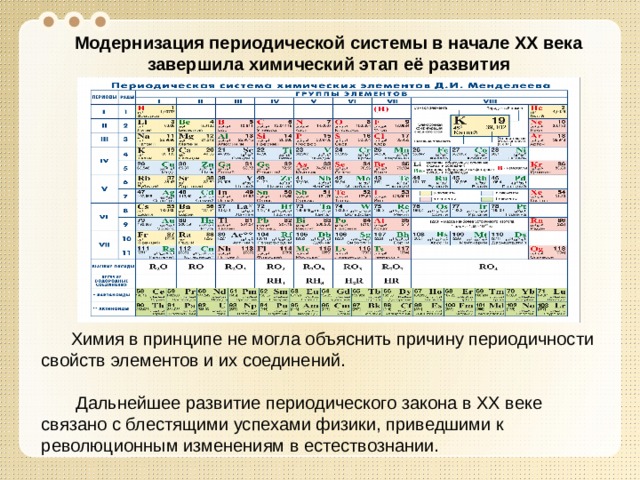
Модернизация периодической системы в начале XX века завершила химический этап её развития
Химия в принципе не могла объяснить причину периодичности свойств элементов и их соединений.
Дальнейшее развитие периодического закона в XX веке связано с блестящими успехами физики, приведшими к революционным изменениям в естествознании.














































