
Дисперсные системы

Дисперсные системы
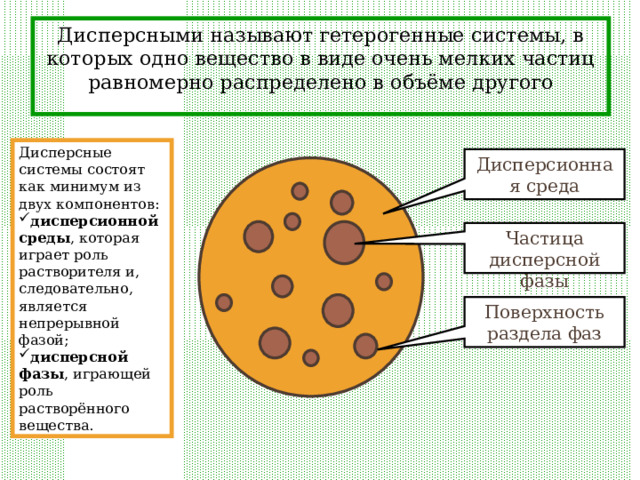
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого
Дисперсные системы состоят как минимум из двух компонентов:
- дисперсионной среды , которая играет роль растворителя и, следовательно, является непрерывной фазой;
- дисперсной фазы , играющей роль растворённого вещества.
Дисперсионная среда
Частица дисперсной фазы
Поверхность раздела фаз
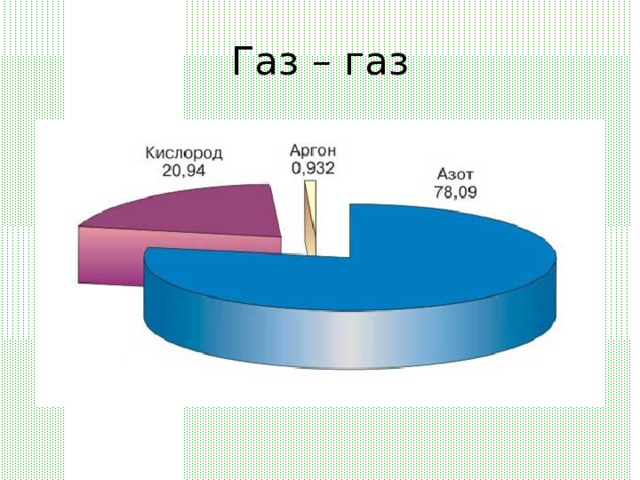
Газ – газ

Газ – жидкость
Туман
Аэрозоль

Газ – твердое вещество
Пыль в воздухе
Дым
Смог

Жидкость – газ
Пена
Шипучие напитки

Жидкость – жидкость
Плазма крови
Соки

Жидкость – твердое вещество
Ил в речной воде
Строительный раствор
Раствор соли

Твердое вещество – газ
Поролон
Пористый шоколад
Кирпич

Твердое вещество – жидкость
Крем
Помада
Тушь

Твердое вещество – твердое вещество
Стекло
Руда
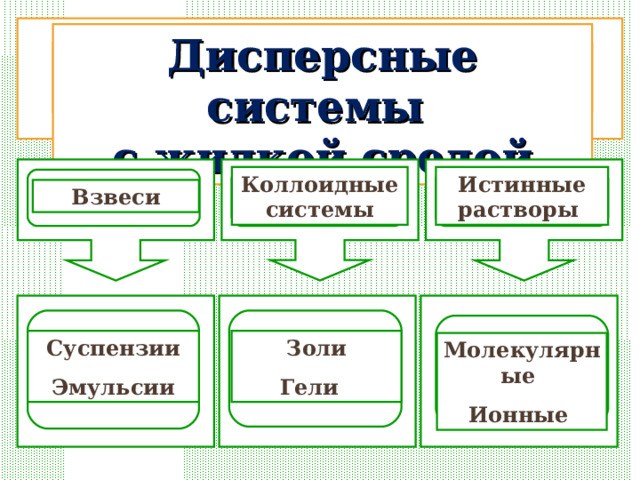
Дисперсные системы
с жидкой средой
Коллоидные системы
Истинные растворы
Взвеси
Суспензии
Эмульсии
Золи
Гели
Молекулярные
Ионные
 100 нм. Это мутные системы, отдельные частицы которых можно заметить невооруженным глазом. Фаза и среда легко разделяются отстаиванием. Среда – жидкость, фаза – твердое вещество Среда и фаза – жидкости " width="640"
100 нм. Это мутные системы, отдельные частицы которых можно заметить невооруженным глазом. Фаза и среда легко разделяются отстаиванием. Среда – жидкость, фаза – твердое вещество Среда и фаза – жидкости " width="640"
Взвеси
Это дисперсные системы, в которых размер частиц фазы 100 нм.
Это мутные системы, отдельные частицы которых можно заметить невооруженным глазом. Фаза и среда легко разделяются отстаиванием.
Среда – жидкость,
фаза – твердое вещество
Среда и фаза – жидкости

Эмульсии
Водоэмульси-онная краска
Молоко
Лечебная косметика

Эмульсии в химической технологии
Каучуки
Поливинил-ацетат
Полистирол

Суспензии
Известковое молоко
Желетелый планктон
Эмалевые краски

Коллоидные системы
- Это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм.
- Эти частицы не видны невооруженным глазом, и фаза и среда отстаиванием разделяются с трудом.
Коллоидные растворы (золи)
Гели или студни

Коллоидные растворы или золи
Клеи
Томатный сок

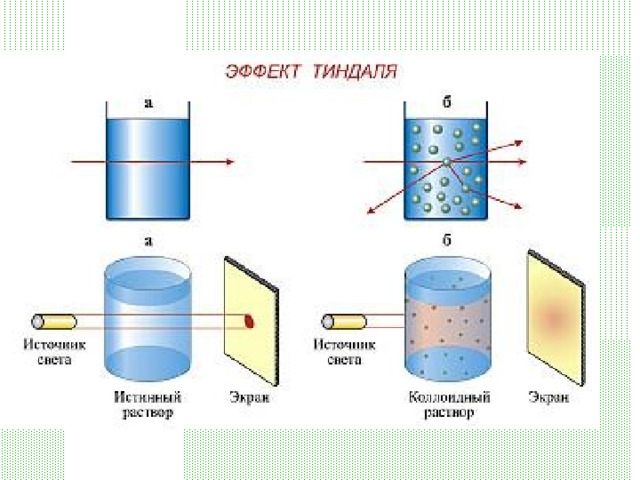
Эффект Тиндаля
- рассеяние света при прохождении светового пучка через оптически неоднородную среду
- Обычно наблюдается в виде светящегося конуса (конус Тиндаля), видимого на тёмном фоне

Коагуляция
- Слипание коллоидных частиц и выпадение их в осадок
- Коагуляция играет важную роль во многих технологических, биологических, атмосферных и геологических процессах

Гели в пищевой промышленности
Желе
Зефир
Заливное
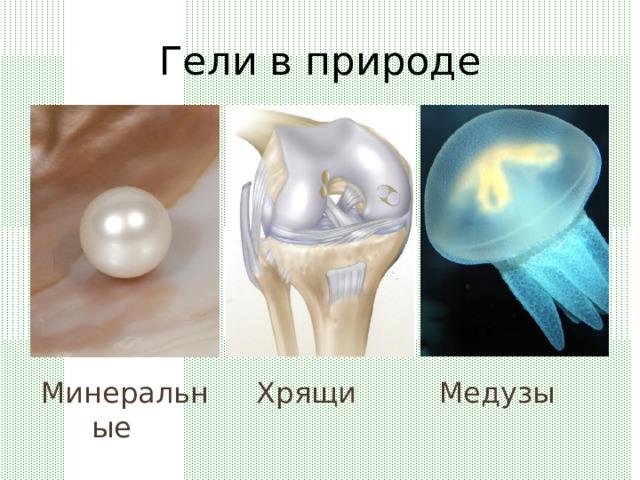
Гели в природе
Минеральные
Медузы
Хрящи

Синерезис
Самопроизвольное уменьшение объема геля, сопровождающееся отделением жидкости
Биологический синерезис сопровождается свертываемостью крови
Синерезис определяет
сроки годности пищевых,
медицинских и
косметических гелей

Истинные растворы
- Это такие дисперсные системы, в которых размер частиц дисперсной фазы не превышает 1 нм.
Это водные растворы органических соединений и слабых электролитов
Это растворы сильных электролитов

Истинные растворы
Гидроксид меди
Раствор глюкозы

Растворение. Растворы.

Физическая теория
Вильгельм Оствальд
Якоб Хендрик Вант-Гофф
Сванте Аррениус
- Растворы – однородные смеси, состоящие из двух или более веществ.
- Растворение – это диффузия.

Химическая теория
В 1887 году доказал, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды
В 1906 году предсказал, что обе точки зрения приведут к общей теории растворов

1. В процессе растворения некоторые вещества меняют цвет
Безводный сульфат меди CuSO 4 белого цвета (слева) при соприкосновении с водой превращается в медный купорос CuSO 4 •5Н 2 О и становится голубого цвета (справа)

2. В процессе растворения может поглощаться и выделяться энергия
При растворении нитрата аммония стаканчик примерзает к деревянной скамейке
При растворении концентрированная серная кислота экзотермически взаимодействует с водой, образуя гидраты.
При растворении гидроксида натрия выделяется тепло .

3. В процессе растворения может уменьшаться объем раствора по сравнению с суммой объема исходных компонентов
Например при растворении спирта в воде между ними возникают водородные связи, приводящие к уменьшению объема.

Физико-химическая теория растворов
- Раствор — гомогенная (однородная) система, состоящая из растворителя, растворенных веществ и продуктов их взаимодействия.
- Растворение – процесс измельчения вещества до структурных единиц (ионов, молекул, атомов) под действием растворителя.
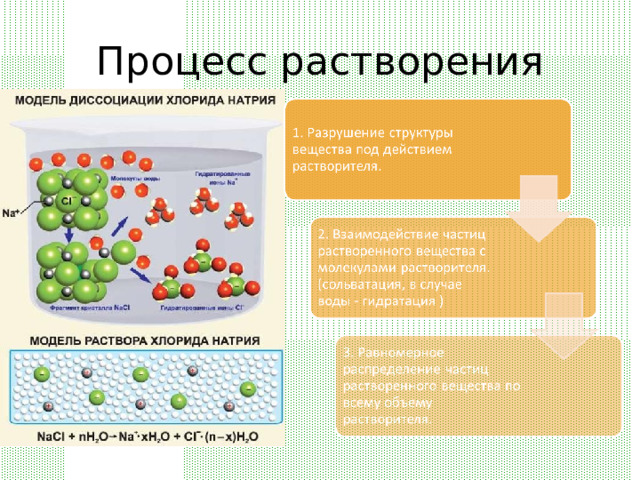
Процесс растворения

Растворы по агрегатному состоянию могут быть
раствор кислорода и углекислого газа в азоте – воздух
1. Газообразные
2. Жидкие:
-в жидкости – газ
-в жидкости – жидкость
-в жидкости – твердое вещество
3.Твердые
-сплавы металлов, амальгамы
-растворы газов в металле

Растворитель и растворимость
1. Растворителем считают то вещество, агрегатное состояние которого при образовании раствора не изменяется
2. Если агрегатные состояния компонентов одинаковы, то растворителем считают тот компонент, которого в растворе больше. Так столовый уксус – это раствор уксусной кислоты в воде, а уксусная эссенция – это раствор воды в уксусной кислоте.
Растворимость - это способность веществ разрушаться до структурных единиц под действием растворителя.
Растворимость зависит от :
-природы вещества,
-природы растворителя.
-температуры,
-давления (для газов)

Растворы
Коэффициент растворимости показывает сколько граммов вещества может растворяться в 100 г растворителя.
В соответствии с этим растворы могут быть:
- насыщенными -раствор, в котором растворённое вещество при данных условиях больше не растворяется.
- ненасыщенными - раствор, в котором при данных условиях можно растворить еще некоторое количество растворенного вещества.
- пересыщенными - раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок.
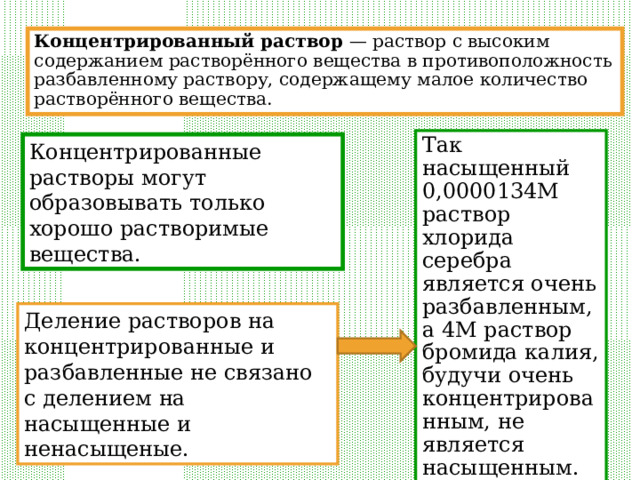
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества.
Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
Концентрированные растворы могут образовывать только хорошо растворимые вещества.
Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные.
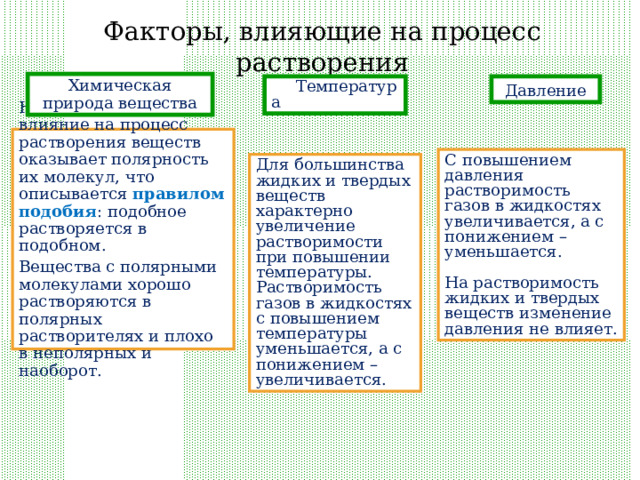
Факторы, влияющие на процесс растворения
Химическая природа вещества
Температура
Давление
Непосредственное влияние на процесс растворения веществ оказывает полярность их молекул, что описывается правилом подобия : подобное растворяется в подобном.
Вещества с полярными молекулами хорошо растворяются в полярных растворителях и плохо в неполярных и наоборот.
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением – уменьшается.
На растворимость жидких и твердых веществ изменение давления не влияет.
Для большинства жидких и твердых веществ характерно увеличение растворимости при повышении температуры.
Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением – увеличивается.

Способы выражения концентрации растворов
Массовая доля растворённого вещества
Молярная концентрация
Массовая концентрация
Это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора
Указывает на массу вещества, находящегося в одном литре раствора:
Показывает, сколько моль растворённого вещества содержится в 1 литре раствора:
М вещества - молярная масса растворенного вещества (г/моль).
Единицей измерения данной концентрации является моль/л (М).
Единица измерения – г/л.
Данным способом часто оценивают состав природных и минеральных вод.
Например, 3%-ный спиртовой раствор йода содержит 3г йода в 100г раствора или 3г йода в 97г спирта.
Например, 1М раствор Н 2 SO 4 - это раствор, содержащий в 1 литре 1 моль (или 98г) серной кислоты .

Теория электролитической диссоциации
ЭД – это процесс распада электролита на ионы (заряженные частицы) под действием полярного растворителя (воды) с образованием растворов, способных проводить электрический ток.
Электролиты – это вещества, способные распадаться на ионы.
Электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества. Это взаимодействие приводит к поляризации связей, в результате чего образуются ионы за счет «ослабления» и разрыва связей в молекулах растворяемого вещества. Переход ионов в раствор сопровождается их гидратацией:

Электролитическая диссоциация
Количественно ЭД характеризуется степенью диссоциации ( α ); она выражает отношение продиссоциированных молекул на ионы к общему числу молекул, растворенных в растворе (меняется от 0 до 1.0 или от 0 до 100%):
n – продиссоциированные на ионы молекулы,
N – общее число молекул, растворенных в растворе.

Электролитическая диссоциация
Характер ионов, образующихся при диссоциации электролитов – различен.
В молекулах солей при диссоциации образуются катионы металла и анионы кислотного остатка:
Na 2 SO 4 ↔ 2Na + + SO 4 2-
Кислоты диссоциируют с образованием ионов Н + :
HNO 3 ↔ H + + NO 3 -
Основания диссоциируют с образованием ионов ОН - :
KOH ↔ K + + OH -
 30%): щелочи (хорошо растворимые в воде основания металлов IA группы – NaOH, KOH ); одноосновные кислоты и серная кислота ( НС l, HBr, HI, Н N О 3, НС lO 4 , Н 2 SO 4 ( разб.) ); все растворимые в воде соли. " width="640"
30%): щелочи (хорошо растворимые в воде основания металлов IA группы – NaOH, KOH ); одноосновные кислоты и серная кислота ( НС l, HBr, HI, Н N О 3, НС lO 4 , Н 2 SO 4 ( разб.) ); все растворимые в воде соли. " width="640"
Электролитическая диссоциация
По степени диссоциации все вещества можно разделить на 4 группы:
1. Сильные электролиты ( α 30%):
- щелочи (хорошо растворимые в воде основания металлов IA группы – NaOH, KOH );
- одноосновные кислоты и серная кислота ( НС l, HBr, HI, Н N О 3, НС lO 4 , Н 2 SO 4 ( разб.) );
- все растворимые в воде соли.

Электролитическая диссоциация
2. Средние электролиты ( 3%
- кислоты – H 3 PO 4 , H 2 SO 3 , HNO 2 ;
- двухосновные, растворимые в воде основания – Mg(OH) 2 ;
- растворимые в воде соли переходных металлов , вступающие в процесс гидролиза с растворителем – CdCl 2 , Zn(NO 3 ) 2 ;
- соли органических кислот – CH 3 COONa.

Электролитическая диссоциация
3. Слабые электролиты (0, 3%
- низшие органические кислоты ( CH 3 COOH, C 2 H 5 COOH );
- некоторые растворимые в воде неорганические кислоты ( H 2 CO 3 , H 2 S, HCN, H 3 BO 3 );
- почти все малорастворимые в воде соли и основания ( Ca 3 (PO 4 ) 2 , Cu(OH) 2 , Al(OH) 3 );
- гидроксид аммония – NH 4 OH ;
- вода.

Электролитическая диссоциация
4. Неэлектролиты ( α≤ 0, 3% ):
- нерастворимые в воде соли, кислоты и основания;
- большинство органических соединений (как растворимых, так и нерастворимых в воде)

Электролитическая диссоциация
Одно и то же вещество может быть как сильным, так и слабым электролитом.
Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку:
- при растворении в воде ведут себя как типичные сильные электролиты ,
- при растворении в ацетоне или уксусной кислоте являются слабыми электролитами со степенью диссоциации меньше единицы;
- в «сухом» виде выступают неэлектролитами .

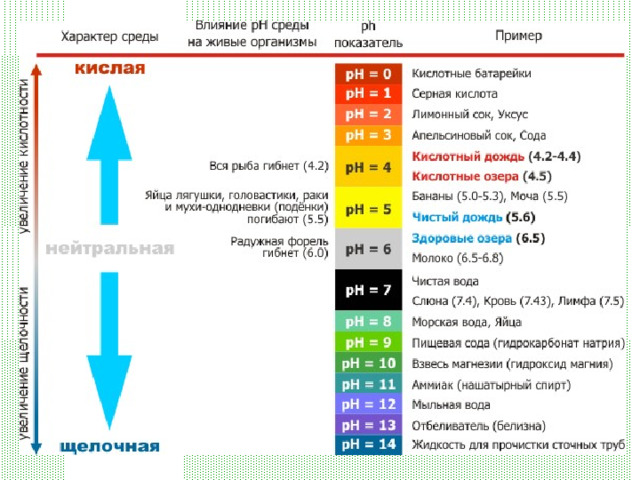
Водородный показатель. Индикаторы
Для определения рН используют кислотно-основные индикаторы – вещества, меняющие свой цвет в зависимости от концентрации ионов Н + и ОН - .
Одним из наиболее известных индикаторов является универсальный индикатор , окрашивающийся при избытке Н + (т.е. в кислой среде) в красный цвет, при избытке ОН - (т.е. в щелочной среде) – в синий и имеющий в нейтральной среде желто-зеленую окраску:




















 100 нм. Это мутные системы, отдельные частицы которых можно заметить невооруженным глазом. Фаза и среда легко разделяются отстаиванием. Среда – жидкость, фаза – твердое вещество Среда и фаза – жидкости " width="640"
100 нм. Это мутные системы, отдельные частицы которых можно заметить невооруженным глазом. Фаза и среда легко разделяются отстаиванием. Среда – жидкость, фаза – твердое вещество Среда и фаза – жидкости " width="640"






























 30%): щелочи (хорошо растворимые в воде основания металлов IA группы – NaOH, KOH ); одноосновные кислоты и серная кислота ( НС l, HBr, HI, Н N О 3, НС lO 4 , Н 2 SO 4 ( разб.) ); все растворимые в воде соли. " width="640"
30%): щелочи (хорошо растворимые в воде основания металлов IA группы – NaOH, KOH ); одноосновные кислоты и серная кислота ( НС l, HBr, HI, Н N О 3, НС lO 4 , Н 2 SO 4 ( разб.) ); все растворимые в воде соли. " width="640"
















