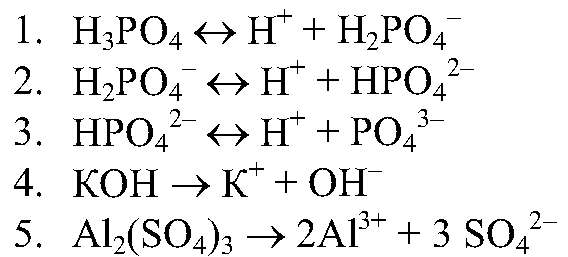Ф.И.О: Магомедова Хадижат Ахмедовна
Тема урока: Теория электролитической диссоциации.
Тип урока: Комбинированный
Цели урока: сформировать знания о степени диссоциации и силе электролитов
Задачи:
Образовательные
Углубить понятия об электролитах и ЭД.
Показать влияние разбавления, температуры на степень диссоциации.
Определить понятие «степень ЭД», сильные и слабые электролиты.
Развивающие
Развивать умение написания реакции диссоциации.
Формировать понятие диссоциированных и недиссоциированных молекул.
Умение определять силу электролита в зависимости от степени диссоциации.
Развивать умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, делать выводы, развивать устную речь.
Воспитательные:
Воспитывать интерес к знаниям, взаимопомощь, чувство товарищества, коммуникабельность, критичность по отношению к себе и другим, развивать самооценку.
Методы обучения:
Общелогические: индукция, абстрагирование, сравнение, конкретизация
Общепедагогические: беседа, рассуждение, самостоятельная работа
Специфические: демонстрационный химический эксперимент, наблюдение и описание химических объектов
Оборудование:
Периодическая система химических элементов Д.И.Менделеева
Для выполнения лабораторной работы: прибор для проверки электрической проводимости растворов, дистиллированная вода, раствор хлорида натрия, сахар
Содержание и методика урока:
Вводная часть
Здравствуйте ребята. Садитесь. Проверим ваши домашние задания.
а) Проверка домашнего задания:
§4 прочитать, вопрос 3, тест (1) на стр.18-19
| Домашнее задание: | Ответы: |
| Вопрос №3 Для какой химической реакции понижение температуры повлияет на смещение химического равновесия в сторону образования продуктов реакции? 3O2=2O3-Q 2H2O=2H2+O2-Q C3H6+H2=C3H8+Q | C3H6+H2=C3H8+Q
|
| Тест (1) Обратимые химические реакции возможны между растворами ZnCL2 и Na2SO4 KOH и HNO3 KNO3 и Na3PO4 AgNO3 и NaCl |
ZnCL2 и Na2SO4 KNO3 и Na3PO4
|
Вызываю к доске 5 учеников( каждому по одно1 реакции).
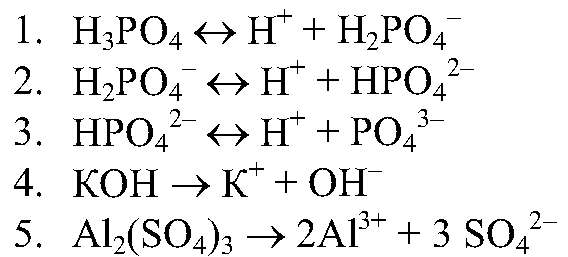
Новая тема
а) Сообщение темы и цели урока:
Из уроков физики вы знаете, что такое электрический ток. Какие вещества хорошо проводят электрический ток? Правильно, металлы. Они хорошо проводят электрический ток, в отличие от неметаллов; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Напишите сегодняшнюю дату и тему «Теория электролитической диссоциации».
Цели урока:
Формирование понятий электролитов и не электролитов, электролитическая диссоциация.
История открытия теории электролитической диссоциации
Основные положения теории электролитической диссоциации.
б) Изучение нового материала.
Сейчас рассмотрим лабораторный опыт на электропроводность растворов.
В гнезда выданной вам керамической пластинки поместите по одной ложечке хлорида натрия и сахара. Прибор для испытания электропроводности включите в сеть и прикоснитесь на несколько секунд электродами поочерёдно к каждому веществу. Что вы наблюдаете?
Правильно, Лампочка не загорается, это говорит о том, что сухие кристаллические вещества не проводят электрический ток.
Аккуратно прилейте в каждое гнездо дистиллированную воду и вновь исследуйте электропроводность. Что вы наблюдаете?
Правильно, Лампочка загорается, значит растворы проводят электрический ток.
Рассмотрим процесс растворения соли в воде с видео-ролика. Кристаллическая решетка соли хлорида натрия состоит из катионов натрия и анионов хлора. При растворении положительный полюс молекулы воды притягивается к отрицательно-заряженному иону хлора, а отрицательный полюс молекулы воды – к положительно-заряженному иону натрию. Притяжение в кристаллической решетке соли ослабевает, решетка разрушается, и кристаллы соли переходят в раствор в виде ионов, связанных с молекулами воды. Весь процесс называют электролитической диссоциацией.
Растворы или расплавы электролитов проводят ток за счет наличия переносчиков заряда - ионов; а неэлектролиты – нейтральные молекулы, которые не способны переносить заряд.
Запишем определения:
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток. (так как при растворении образуются ионы)
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток. (так как при растворении образуются молекулы)
Схема на доске с примерами:
Электролиты: H2SO4, HCl, HNO3, KCl, Na2SO4, AgNO3, NaOH, KOH, Ba(OH)2.
Неэлектролиты: CaO, ZnO, CuO, CH3COOH, C2H5OH, C12H22O11, N2, O2, Cl2.
К электролитам относятся: кислоты, основания, соли.
История открытия теории электролитической диссоциации.
История возникновения теории электролитической диссоциации связана с именем шведского физико-химика Сванте Аррениуса (1859— 1927). В 1882 году он окончил университет в Упсале. В 1895 году становится профессором физики Стокгольмского университета.
После того как были созданы основные положения этой теории, Аррениус показал ее применимость в различных областях естествознания. За разработку теории электролитической диссоциации Аррениус в 1903 году был удостоен Нобелевской премии.
Теория электролитической диссоциации впоследствии была усовершенствована благодаря работам, прежде всего, Н. Бьеррума, П. Дебая и Э. Хюккеля.
Записываем определение и положения:
«Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.»
Схема на доске:
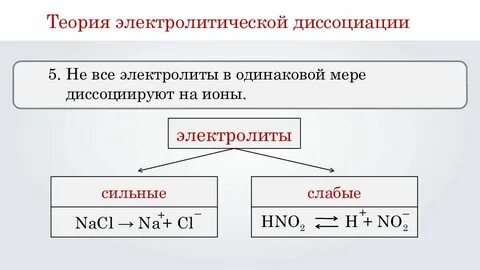
Сильными электролитами принято считать электролиты, степень диссоциации которых больше 30%.
К сильным электролитам относятся:
1) все растворимые соли ( KCl, BaI2, ZnSO4)
2) сильные кислоты (H2SO4, HCl, HNO3,HI, HBr, HCl);
3) все щелочи (NaOH, KOH).
Электролитами средней силы принято считать электролиты, степень диссоциации которых меньше 30%, но больше 3%.
Малорастворимые соли ( PbF2, CaSO4, ZnSO3)
Кислоты H3PO4, HF
Малорастворимые основания ( Ca(OH)2, Mg(OH)2)
Слабые электролиты – такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю. Слабыми электролитами считаются электролиты, степень диссоциации которых меньше 3%.
К слабым электролитам относятся:
1) слабые кислоты (H2S, H2CO3, HNO2, H2SO3);
2) Нерастворимые соли (CuS, CaCO3, BaF2)
3) Нерастворимые основания ( Zn(OH)2, Fe(OH)3, Cr(OH)3)
3) вода.
Основные положения теории электролитической диссоциации:
1. Электролиты при растворении в воде диссоциируют на ионы – положительные и отрицательные.
2. Причиной диссоциации электролита в водных растворах является действие полярных молекул воды.
3. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами. (катод заряжен отрицательно, а анод – положительно).
в) Закрепление изученного материала
И так, сегодня на уроке мы рассмотрели электролитов, неэлектролитов. Узнали, что химия связана и с физикой. В природе существуют много веществ, проводящие электрический ток.
А теперь решим кроссворд, первые 3 пары, ответившие правильно получают оценку «5» , остальные «4»
Работа в парах: Решение кроссворда:
|
|
|
|
|
|
|
|
| 3 |
|
|
|
| 4 |
|
|
|
|
| 1 |
|
| 2 |
|
| К |
|
|
|
| К |
|
|
|
|
| А |
|
| Э |
|
| А |
|
|
|
| А |
|
|
|
| 1 | Н | Е | Э | Л | Е | К | Т | Р | О | Л | И | Т |
|
|
|
|
| И |
|
| Е |
|
| О |
|
|
|
| И |
|
|
|
|
| О |
|
| К |
|
| Д |
|
|
|
| О |
|
|
|
|
| Н |
|
| Т |
|
|
|
|
|
|
| Н |
|
|
|
|
|
|
|
| Р |
|
| 5 |
|
|
|
|
|
|
|
| 2 | Д | И | С | С | О | Ц | И | А | Ц | И | Я |
|
|
|
|
|
|
|
|
|
| Л |
|
| Р |
|
|
|
|
|
|
|
|
| 3 | С | О | Л | И |
|
| Р |
|
|
|
|
|
|
|
|
|
|
|
|
| Т |
|
| Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | И | О | Н | Ы |
|
|
|
|
|
|
|
|
|
|
|
|
| У |
|
|
|
|
|
|
|
|
|
|
|
|
| 5 | А | С | С | О | Ц | И | А | Ц | И | Я |
По вертикали:
1.Отрицательно-заряженная частица.
2.Вещество, растворы или расплавы которого проводят электрический ток – это..
3. Отрицательно-заряженный электрод.
4. Положительно-заряженная частица.
5. Фамилия шведского ученого, который сформулировал положения теории электролитической диссоциации.
По горизонтали:
1. Вещество, раствор или расплав которого не проводит электрический ток – это…
2. Процесс распада электролита на ионы при его растворении или плавлении – это..
3. Класс соединений, которые при растворении диссоциируют на ионы и проводят электрический ток.
4. При растворении в воде электролиты диссоциируют (распадаются) на…
5. Процесс соединения ионов в молекулы – это …
в) Закрепление изученного материала
Чтобы закрепить сегодняшнюю тему ответьте на вопросы письменно на тетради, и в конце урока сдайте на проверку.
| Вопрос учителя | Предполагаемые ответы |
| Почему раствор сахара не проводит электрический ток, а раствор хлорида натрия проводит? | Раствор сахара не проводит электрический ток потому, что сахар является неэлектролитом, т. е. при растворении не распадается на ионы. |
| Что называется электролитической диссоциацией? | Процесс распада электролита на ионы при его растворении или плавлении |
| К каким электролитам относятся ZnSO4, HBr, NaOH | Сильные электролиты |
| К каким электролитам относятся CaCO3, HNO2, Fe(OH)3 | Слабые электролиты |
Заключительная часть
а) Подведение итогов урока: Сегодня мы изучали новую тему «Теория электролитической диссоциации». И узнали что такое электролиты, неэлектролиты, электролитическая диссоциация, историю открытия теории электролитической диссоциации, основные положения теории электролитической диссоциации.
б) Сообщение домашнего задания:
Ребята, запишите домашнее задание. Дома прочитать параграф, выучить основные определения, ответить на вопросы 2,3 на странице 25 письменно в тетрадях.
Литература
Рудзитис Г.Е. Химия / Г. Е. Рудзитис, Ф. Г. Фельдман. – 2-е изд. – Москва : Просвещение, 2016. – 208 с. – Текст : непосредственный.
Габриелян О.С. Химия / О. С. Габриелян. – 16-е издание. – Москва : Дрофа, 2009. – 270 с. – Текст : непосредственный.
Гузей Л. С. Химия / Л. С. Гузей, В. В. Сорокин, Р. П. Суровцева. – 7-е изд. – Москва : Дрофа, 2003. – 280 с. - Текст : непосредственный.