Пояснительная записка.
Настоящая программа элективного курса “Решение расчетных задач по химии” предназначена для учащихся 8 классов общеобразовательной школы. Реализация программы осуществляется на основе межпредметных связей химии с математикой, физикой.
Содержание курса включает в себя практические работы и типы расчетных задач, предусмотренные основной программой для 8 класса, а также расчетных задач для углубленного изучения химии. Программа предусматривает овладение учащимися методикой решения всех типов расчетных задач за 8 класс, а также ряда задач, выходящих за рамки изучения в курсе химии 8 класса.
Содержание курса предназначено для овладения теоретическим материалом по химии. Это даст возможность лучше и глубже изучить и понять многие химические процессы и закономерности, а так же даст возможность выработать элементарный навык в решении задач, что очень часто не хватает на уроках при прохождении программы. Усвоение методов решения задач возможно в результате сопоставления самостоятельных решений с решениями, приведенными в приложении.
Математический аппарат не сложен, так как базируется на общеизвестных расчетах задач, формулах, приведенных в приложении. Расчеты по химическим уравнениям удобнее всего вести с использованием количества вещества.
Цели программы
Образовательные:
Формирование единой системы химических знаний об окружающем мире и химических законах природы;
Формирование научного и философско-гуманистического мировоззрения, основанного на глубоком знании и осмыслении взаимодействия человека с окружающим миром;
Освоение основных методов и приемов научного исследования;
Создание фундамента для продолжения химического образования в дальнейшем.
Развивающие:
Развитие интеллектуальных способностей учащихся, гибкости и самостоятельности мышления;
Формирование навыков самообразования и умения применять полученные знания в практической деятельности;
Развитие логического и аналитического мышления, стремления к поиску нестандартных и оригинальных подходов к решению задач;
Развитие экспериментальных умений и навыков.
Воспитательные:
Формирование самостоятельной, самодостаточной, независимой личности, способной свободно ориентироваться в окружающем мире;
Формирование осмысленного и бережного отношения к себе и окружающему миру, воспитание нравственности, гуманизма, экологической культуры;
Формирование понимания общественной значимости, гуманистической направленности химии, ее существенной роли в процессе познания мира и практической деятельности человека.
Задачи программы
Расширение и углубление знаний учащихся по неорганической химии;
Овладение учащимися основными приемами решения расчетных задач по химии;
Развитие умения применять теоретические знания при решении расчетных и качественных задач;
Развитие навыков самостоятельной работы;
Привитие интереса к химии.
Ожидаемые результаты:
Полученные знания должны помочь учащимся:
определиться в выборе индивидуальных образовательных потребностей (профиля обучения);
научиться обращаться со сверстниками, учителями, отстаивать свою точку зрения;
закрепить практические навыки и умения при решении задач;
выполнять творческие задания;
В процессе обучения на занятиях курса учащиеся приобретают следующее знания:
Календарно-тематическое планирование
курса «Решение расчетных задач»
(1час в неделю, всего 34 часов)
| № | п/п | Тема | Теоретический урок | Практический урок | Сроки |
Введение (2 часа) |
| 1 | 1 | Предмет химии. Понятие об алхимии. Химическая символика, и название. | 1 |
|
|
| 2 | 2 | Правила техники безопасности в кабинете химии. Правила обращения с химической посудой. |
| 1 |
|
Вычисления с химическими формулами (6 часов) |
| 3 | 1 | Вычисление относительной молекулярной массы вещества | 1 |
|
|
| 4 | 2 | Вычисления массовой доли элемента в соединении | 1 |
|
|
| 5 | 3 | Валентность. Нахождение валентности по формуле | 1 |
|
|
| 6 | 4 | Составление формулы по валентности | 1 |
|
|
| 7 | 5 | Вычисление массы, количество молекул с помощью количества вещества | 1 |
|
|
| 8 | 6 | Решение задач на молярный объем и относительную плотность газов при н.у. | 1 |
|
|
Задачи на плотность (4 часа) |
| 9 | 1 | Определение относительной плотности газов | 1 |
|
|
| 10 | 2 | Вывод формулы вещества по известным массовым отношениям элементов, входящих в его состав | 1 |
|
|
| 11 | 3 | Нахождение молекулярной формулы углеводорода по его плотности и массовой доле элементов | 1 |
|
|
| 12 | 4 | Контрольная работа-тест на тему: «Первоначальные химические понятия» |
| 1 |
|
Вычисления по уравнениям химических реакций (7 часов) |
| 13 | 1 | Вычисление массы одного из веществ по известной массе другого вещества | 1 |
|
|
| 14 | 2 | Вычисление объема одного из веществ по известному объему другого вещества | 1 |
|
|
| 15-16 | 3-4 | Расчеты: массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. | 2 |
|
|
| 17 | 5 | Задачи на избыток одного из реагирующих веществ. | 1 |
|
|
| 18- 19 | 6- 7 | Вычисление теплового эффекта по массе одного из реагирующих веществ. Составление термохимического уравнения по массе вещества и тепловому эффекту | 2 |
|
|
Вычисления связанные с растворами (5 часов) |
| 20 | 1 | Вычисление массовой доли растворенного вещества в растворе | 1 |
|
|
| 21 | 2 | Вычисление массы растворителя и растворенного вещества по известной массе раствора и массовой доле растворенного вещества | 1 |
|
|
| 22- 23 | 3- 4 | Расчеты с использованием плотности раствора. Расчеты связанные с растворимостью вещества. | 2 |
|
|
| 24 | 5 | Приготовление растворов с определенной массовой долей растворенного вещества или молярной концентрацией раствора |
| 1 |
|
Окислительно-восстановительные реакции (ОВР) (2 часа) |
| 25 | 1 | Виды ОВР | 1 |
|
|
| 26 | 2 | Составление уравнений ОВР методом электронного баланса. | 1 |
|
|
Задачи на классы неорганических соединений (8 часов) |
| 27 | 1 | Задачи на оксиды | 1 |
|
|
| 28 | 2 | Задачи на основания | 1 |
|
|
| 29 | 3 | Задачи на кислоты | 1 |
|
|
| 30 | 4 | Задачи на соли | 1 |
|
|
| 31 | 5 | Генетическая связь между основными классами неорганических соединений |
| 1 |
|
| 32 | 6 | Задачи на выход продукта реакции. | 1 |
|
|
| 33 | 7 | Тест по теме «Классы неорганических соединений» | 1 |
|
|
| 34 | 8 | Итоговый экзамен | 1 |
|
|
Требования к знаниям и умениям учащихся.
Учащиеся должны уметь:
Проводить опыты с соблюдением правил техники безопасности;
Обращаться с простейшей посудой и лабораторным оборудованием;
Обращаться с нагревательными приборами;
Обращаться с измерительными приборами, техническими весами;
Растворять твердые вещества и жидкости в воде;
Готовить растворы с определенной массовой долей растворенного вещества или молярной концентрацией раствора;
Учащиеся должны вычислять:
Массовые доли и массовые отношения элементов в сложном веществе;
Проводить вычисления с количеством вещества;
Выводить формулы веществ по массовым долям и массовым отношениям элементов;
Содержание элемента в данной порции вещества;
Массовую долю растворенного вещества и молярную концентрацию раствора;
Решать задачи на разбавление и смешение растворов;
Проводить вычисления по уравнениям реакций;
Решать задачи на избыток одного из исходных веществ;
Проводить вычисления по уравнениям реакций в растворах;
Решать задачи на выход продукта;
Проводить вычисления по уравнениям реакций, если исходное вещество дано в смеси;
Проводить вычисления по уравнению состояния идеального газа;
Тепловые эффекты химических реакций;
Проводить вычисления по уравнениям нескольких последовательных реакций;
Критерии достижений учащихся
Темы рефератов:
1.Основные этапы в истории химии
2.Атомно-молекулярное учение
3.Основные законы химии. Закон сохранения массы
4. Основные законы химии. Закон постоянства состава
5.Основные законы химии. Газовые законы
6.Растворимость веществ в воде
7. Основные типы химических реакций
8.Тепловые явления в растворах при растворении
9. Генетическая связь между основными классами неорганических соединений
Список литературы.
А. Е. Темирбулатова. Сборник задач и упражнений по химии 8 класс. А., Мектеп. 2012
И.Г.Хомченко. Сборник задач и упражнений по химии для средней школы. М., Новая волна. 2004.
Н.Е.Кузьменко, В.В.Еремин. 2400 задач по химии. М., Дрофа. 1999.
Р.А.Лидин, Л.Ю.Аликберова. Справочник по химии. М., Аст-Пресс Школа. 2002.
Приложение 1.
Основные химические и физические величины, формулы.
1.Количество вещества, молярный объем газов
Определения:
Моль – такое количество вещества, в котором содержится 6∙1023 молекул этого вещества.
Молярная масса – масса 1 моль вещества.
Постоянная Авогадро – число молекул, содержащееся в 1 моль любого вещества - 6∙1023
Молярный объем – объем газа количеством вещества 1 моль, измеренный при н.у. – 22,4 л/моль
Относительная плотность газа – отношение массы определенного объема газа к массе такого же объема другого газа
Закон Авогадро: одинаковые объемы различных газов при одинаковых условиях содержат одинаковое число молекул
Следствие из закона Авогадро: при одинаковых условиях 1 моль любого газа занимает одинаковый объем
Закон объемных отношений: при одинаковых условиях объемы газов, вступающих в реакцию, относятся друг к другу, а также к объемам газообразных продуктов как небольшие целые числа
Буквенные обозначения:
Количество вещества - n
Молярный объем - Vm
Молярная масса - M
Масса - m
Число молекул - N
Постоянная Авогадро - Na
Объем – V
Относительная плотность газа по другому газу – D
Плотность вещества - ρ
Основные формулы: n=� � ; n= �
� ; n= � � ; n=�
� ; n=� � ; D=�
� ; D=� � ; m=ρ∙V
� ; m=ρ∙V
Система единиц:
|
| Масса (m) | Количество вещества (n) | Молярная масса (M) | Объем (V) | Молярный объем (Vm) | Число Авогадро (Na) |
| основная | г | моль | г/моль | л | л/моль | 66∙1023 молекул/моль |
| В 1000 раз больше | кг | кмоль | кг/кмоль | м3 | м3/кмоль | 66∙1026 молекул/моль |
| В 1000 раз меньше | мг | ммоль | мг/ммоль | мл | мл/ммоль | 66∙1020 молекул/моль |
2.Массовая доля.
Массовая доля элементов в веществе.
Буквенные обозначения
ω – массовая доля (в долях от целого или в %)
Ar – относительная атомная масса элемента
Mr – относительная молекулярная масса химического соединения
Основные формулы:
ω=� �∙100%
�∙100%
3. Массовая и объемная доли компонентов смеси (раствора).
Буквенные обозначения
ω – массовая доля (в долях от целого или в %)
φ – объемная доля (в долях от целого, реже в %)
Основные формулы:
m=ρ∙V (ρ – плотность вещества, V – объем вещества)
ω=� �∙100%
�∙100%
φ =� �
�
4.Расчет массовой или объемной доли выхода продукта реакции
от теоретически возможного.
Выход продукта реакции от теоретически возможного (η) – это отношение массы (объема, количества) реально полученного вещества к его теоретически возможной массе (объему, количеству), которое рассчитывается по уравнению химической реакции.
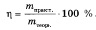
6.Расчет теплового эффекта реакции.
Экзотермические реакции – протекают с выделением теплоты +Q
Эндотермические реакции – протекают с поглощением теплоты –Q
Теплоту реакции записывают в конце уравнения, называют тепловым эффектом реакции, измеряется в Дж и кДж.
Термохимические уравнения – химические уравнения, в которых указывается тепловой эффект.
Для термохимических уравнений существует прямо пропорциональная зависимость между количеством исходного вещества и количеством выделившейся или поглощенной теплоты.
Приложение 2.
Алгоритм решения задачи
1. Внимательно прочтите условия задачи 2-3 раза.
2. Кратко запишите, что дано (известно) по условию задачи, что надо определить.
3. Выявите химическую сущность задачи.
4. Составьте необходимые для расчета уравнения всех химических реакций или формулы в зависимости от условия задачи.
5. На основе логического анализа условия задачи запишите расчетные формулы, необходимые для ее решения.
6. Определите, какие единицы массы, объема или количества вещества наиболее рационально использовать в данной задаче.
7. Проведите математические расчеты и запишите ответ.
1. Решение задач по химическим уравнениям.
Расчет массы вещества или объема газа по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
Алгоритм решения.
1.Записать «Дано»
2.Составить уравнение реакции
3.Над формулами веществ записать значения известных и неизвестных величин с соответствующими единицами измерения (только для чистых веществ). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества; если в задаче идет речь о растворе, то сначала нужно вычислить массу растворенного вещества.
4.Под формулами веществ с известными и неизвестными величинами записать соответствующие значения этих величин, найденные по уравнению реакции.
5.Составить и решить пропорцию.
6.Записать ответ.
2.Решение задач на избыток-недостаток.
Этапы решения:
1.Записать уравнение реакции, расставить коэффициенты.
2. Над и под формулами в уравнении записать данные по условию и по уравнению.
3.Находим количество получившегося вещества по избытку и недостатку.
4. Найти вещество, имеющееся в избытке, рассчитать его количество (массу, объем).
Задачи.
Задачи части С.
Расчеты: массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Общие принципы решения.
1.Составить уравнения реакций тех превращений, которые упоминаются в условии
2.Рассчитать количества и массы чистых веществ
3.Установить причинно-следственные связи между реагирующими веществами, то есть определить – количеств какого вещества требуется найти, и по какому из реагирующих веществ будет производиться расчет
4.Произвести расчеты по уравнениям реакций, то есть рассчитать количество искомого вещества, после чего найти его массу или объем.
5.Ответить на дополнительные вопросы, сформулированные в условии
Решение задач С.
Нахождение молекулярной формулы вещества.
1.Определение формулы по известному элементному составу.
1.определить количественный состав вещества, т.е. найти количество каждого элемента, содержащегося в определенной порции вещества.
2.определить простейшее отношение количеств элементов, т.е. найти простейшие индексы.
3.Составить простейшую формулу вещества и вычислить ее молярную массу.
4.Определить истинную молярную массу из дополнительных условий.
5. Найти коэффициент кратности и определить истинную формулу вещества.
2.Определение формулы вещества по продуктам сгорания
1.Определить количественный состав вещества, т.е. найти массу и количество вещества каждого элемента, содержащееся в определенной порции вещества
2.определить простейшее соотношение количеств элементов, т.е. найти простейшие индексы
3.составить простейшую формулу вещества и вычислить ее молекулярную массу.
4.Определитьь истинную молярную массу из дополнительных условий
5.Найти коэффициент кратности и составить истинную формулу вещества.
3.Определение формулы вещества по известной общей формуле и массовой доле одного из элементов
1.Составить общую формулу вещества данного класса
2.Записать выражение для массовой доли элемента в соединении и найти значение индекса «n».
4.Определение формулы вещества по его реакционной способности.
Решение подобных задач сводится к алгоритмическому расчету уравнения реакции с тем отличием, что формула неизвестного вещества записывается в общем виде.
















