Просмотр содержимого документа
«Электролитическая диссоциация»

1.Что такое равновесие? 2. Что называется смещением равновесия или сдвигом? 3. Как определяется направление смещения равновесия?
4. Укажите все возможные способы смещения равновесия в системе в сторону продуктов реакции:
2SO2(г) + O2(г) ↔ 2SO3(г) + Q;

Электролитическая диссоциация

Вещества
- вещества, растворы и расплавы которых не проводят электрический ток.
- вещества, растворы и расплавы которых не проводят электрический ток.

Неэлектролиты
- вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы.
- газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).

Электролиты
- Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы.
- Неорганические кислоты, основания, соли.

Электролитическая диссоциация – процесс распада электролитов на ионы при растворении в воде или расплавлении

Шведский ученый Сванте Аррениус(1859-1927)
- В 1887 году создал теорию ЭД.
- В 1903году был удостоен Нобелевской премии
"За чрезвычайные заслуги в развитии химии".

Основные положения ТЭД
1. Электролиты в водной среде (и в
расплавленном состоянии) распадаются
на положительно заряженные ионы
(катионы) и отрицательно заряженные
ионы (анионы).

Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов .
- CaCl 2 = Ca 2+ + 2Cl -
- KAl(SO 4 ) 2 = K + + Al 3+ + 2SO 4 2-
- HNO 3 = H + + NO 3 -
- Ba(OH) 2 = Ba 2+ + 2OH -

Основные положения ТЭД
2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.

Основные положения ТЭД
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости .
NaCl Na + + Cl -
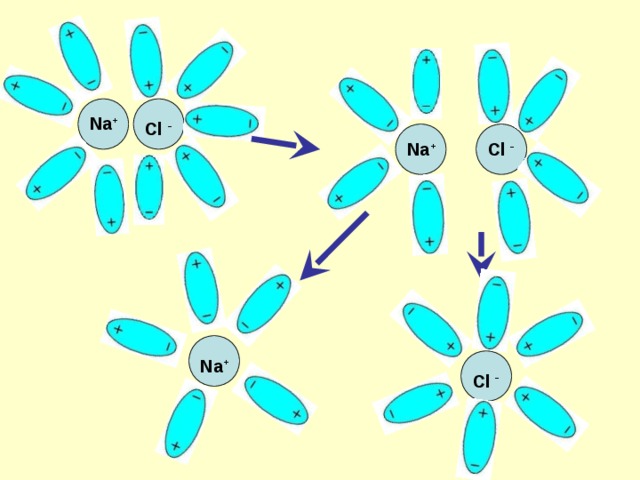
Na +
Cl -
Na +
Cl -
Na +
Cl -

Степень диссоциации
Степень диссоциации - число, которое показывает какая часть молекул распалась на ионы

Электролиты
- при растворении
в воде практически
полностью
распадаются на
ионы.
распадаются на
ионы. Их растворы
содержат ионы и
нераспавшиеся
молекулы, поэтому
концентрация ионов
мала.

Сильные электролиты
- вещества с ионными или сильно полярными связями.
- все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO 4 , H 2 SO 4 ,HNO 3 ) и сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, Вa(OH) 2 , Sr(OH) 2 , Сa(OH) 2 .

Слабые электролиты
вещества с неполярными и малополярными связями:
1) почти все органические кислоты ( CH 3 COOH, C 2 H 5 COOH и др.);
2) некоторые неорганические кислоты ( H 2 CO 3 , H 2 S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca 3 (PO 4 ) 2 ; Ca(OH) 2 ; Al(OH) 3 ; NH 4 OH) ;

Диссоциация кислот
Кислоты - при диссоциации образуют
катионы водорода и анионы кислотного
остатка.
- H Cl = H + + Cl -
- H 2 SO 4 = H + + HSO 4 -
- HSO 4 - = H + + SO 4 2-

Диссоциация оснований
Основания - при диссоциации образуют катионы металла и анионы - гидроксид-ионы.
Ba(OH) 2 = Ba 2+ + 2OH -
Сa(OH) 2 = Сa 2+ + 2OH -

Диссоциация солей
- Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну ступень:
- CaCl 2 = Ca 2+ + 2Cl -
- KBr = K + + Br -
- NaCl = Na + + Cl -

Диссоциация солей
- Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода, распадаются ступенчато. Сначала отрываются все атомы металла, а затем атомы водорода по- одному.
- KHCO 3 = K + + HCO 3 −
- HCO 3 − = H + + CO 3 2-

Благодарю за работу!














































