Практическая работа № 19
Раздел 2. Молекулярная физика
Тема 2.2. Уравнение состояния идеального газа
Название практической работы: Газовые законы. Изопроцессы
Учебная цель: изучать связь между тремя макроскопическими параметрами газа, – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Учебные задачи: По диаграммам изменения состояния идеального газа определять закон, описать изменения основных параметров газа (давление, температура, объём) в ходе процесса; перестраивать этот же цикл в других координатах.
Правила безопасности: правила проведения в кабинете во время выполнения практического занятия
Норма времени: 2 часа
Образовательные результаты:
Студент должен
уметь: пользоваться приборами (сильфон, манометр, термометр, барометр)
знать: уравнение состояния идеального газа, понимать зависимость между макроскопическими параметрами (p,V,T), характеризующими состояние газа, смысл законов: Бойля – Мариотта, Гей-Люссака. Шарля
Обеспеченность занятия (средства обучения):
- методические указания по выполнению практического занятия
- рабочая тетрадь и т.п.
Порядок проведения занятия:
Для выполнения практической работы учебная группа распределяется по индивидуальным вариантам (всего тридцать).
Теоретическое обоснование уравнение состояния идеального газа – закон, связывающий между собой три макроскопических параметра газа: температуру, давление и объём. pV= υRT Изотермический процесс – процесс перехода идеального газа из одного состояния в другое без изменения температуры. Закон, описывающий связь меду параметрами газа при таком процессе, называется закон Бойля-Мариотта в честь двух учёных, практически одновременно выведших его: англичанина Роберта Бойля и француза Эдма Мариотта (рис.1). График - изотерма
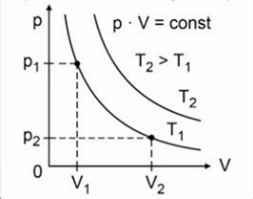
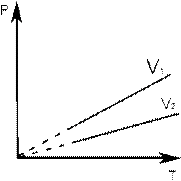
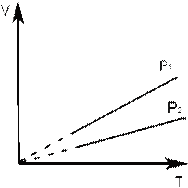
Рис.1 Рис. 2 Рис.3
Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 2), поэтому закон носит его имя. закон Гей-Люссака
p = const  =const. График - изобара
=const. График - изобара
Изохорный (или изохорический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении объёма. Процесс рассмотрен впервые французом Жаком Шарлем (рис. 3), поэтому закон носит его имя. Запишем закон Шарля:
V = const 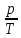 = const. График - изохора
= const. График - изохора
Содержание и последовательность выполнения практической работы:
Задачи практической работы:
Провести анализ отдельных газовых законов, представленных на диаграммах состояний дать общую характеристику каждого процесса, рисунок 4.
Указать закон, которому подчиняются параметры идеального газа в данном процессе; Описать изменения основных параметров газа (давление, температура, объём) в ходе процесса. Построить этот процесс в координатах p,V; p,T; V, T
При изображении процессов использовать разные цвета:
изотермы – красный цвет; изохоры – зелёный цвет; изобары – синий цвет, рисунок 5


Пример выполнения и оформления
Пример выполнения задания вариант № 30
Участок 1- 2
Изотермическое сжатие газа, T = const, T2 = T1
Рис.4
Рис.5
Линия 1 – 2 – изотерма.
Закон Бойля – Мариотта: рV = const
Объём газа уменьшается: V2 V1
давление газа увеличивается: р2 p1
Участок 2 – 3
Изобарное нагревание газа, p = const, p3 = p2
Линия 2 – 3 - изобара
Закон Гей – Люссака: V/Т = const
Температура газа возрастает: T3 T2
В соответствии с законом Гей – Люссака объём газа также увеличивается: V3 V2
Участок 3 – 4
Изотермическое расширение газа, T = const, T4 = T3
Линия 3 – 4 – изотерма
Закон Бойля – Мариотта p V = const
Объём газа: увеличивается V4 V3
В соответствии с законом Бойля – Мариотта давление газа: уменьшается:
p4 p3
Участок 4 – 1
Изобарное охлаждение газа, p = const, p1 = p4
Линия 4 – 1 - изобара
Закон Гей – Люссака: V / Т = const
В соответствии с законом Гей – Люссака объём газа также уменьшается:
V1 V4
Диаграммы процессов в координатах p,V; p,T; V, T
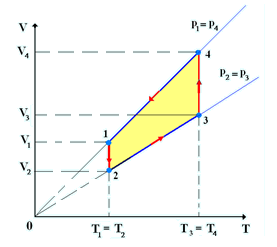
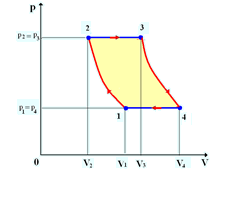

Рис.7
Рис.8
Рис.6
По окончанию практической работы студент должен ответить на
вопросы и предоставить тетрадь в соответствии с требованиями
1. Во сколько раз объём V3 больше объёма V2 и во сколько раз температура T3 больше температуры T2? Соответствует ли такое изменение V и T закону процесса перехода 2 – 3?
2. С помощью какой диаграммы и как графически определить работу газа в цикле 1– 2– 3 – 4 –1?
3. Запишите первое начало термодинамики для процессов 1 – 2 и 3 – 4. Чем отличаются эти процессы с точки зрения первого начала термодинамики?
4. Какие процессы в данном цикле протекают с поглощением тепла, а какие с её выделением?
Ответы
1.С помощью линейки измеряем на диаграмме V,T отрезки OV3, OV2, OT2, находим их средние значения, которые в соответствующем масштабе (например м3 /см и К /см) определяют значения объёмов V3 и V2 и температур T3 иT2. Находим отношения V3 / V2 2,5 и T3 / T2 2,5, откуда получаем V2 / T2 = V3 / T3, что соответствует постоянству отношения объёма к температуре – закону Гей – Люссака: V / T = const.
2. Работа газа в цикле 1 – 2 – 3 – 4 графически определяется по графикам в координатах p,V: элементарная работа газа подсчитывается по формуле
А = p V; полная работа газа А = А и определяется площадью ограниченной
Список литературы:
Дмитриева В.Ф. Физика для профессий и специальностей технического профиля. – М.: ИД Академия, 2013
Библиотека «Первого сентября» 10 класс Молекулярная физика -М.2015










 =const. График - изобара
=const. График - изобара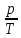 = const. График - изохора
= const. График - изохора














