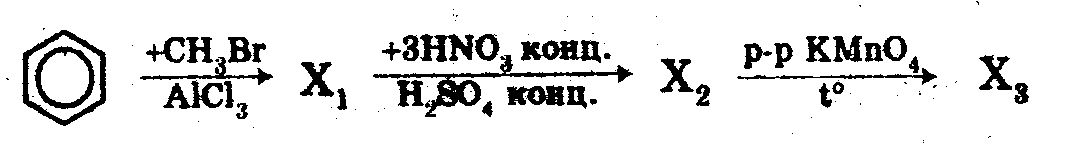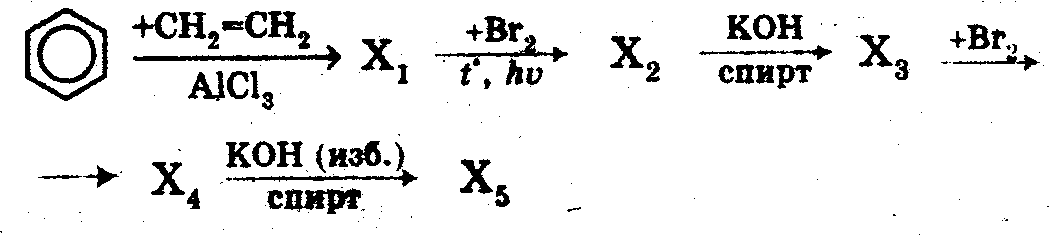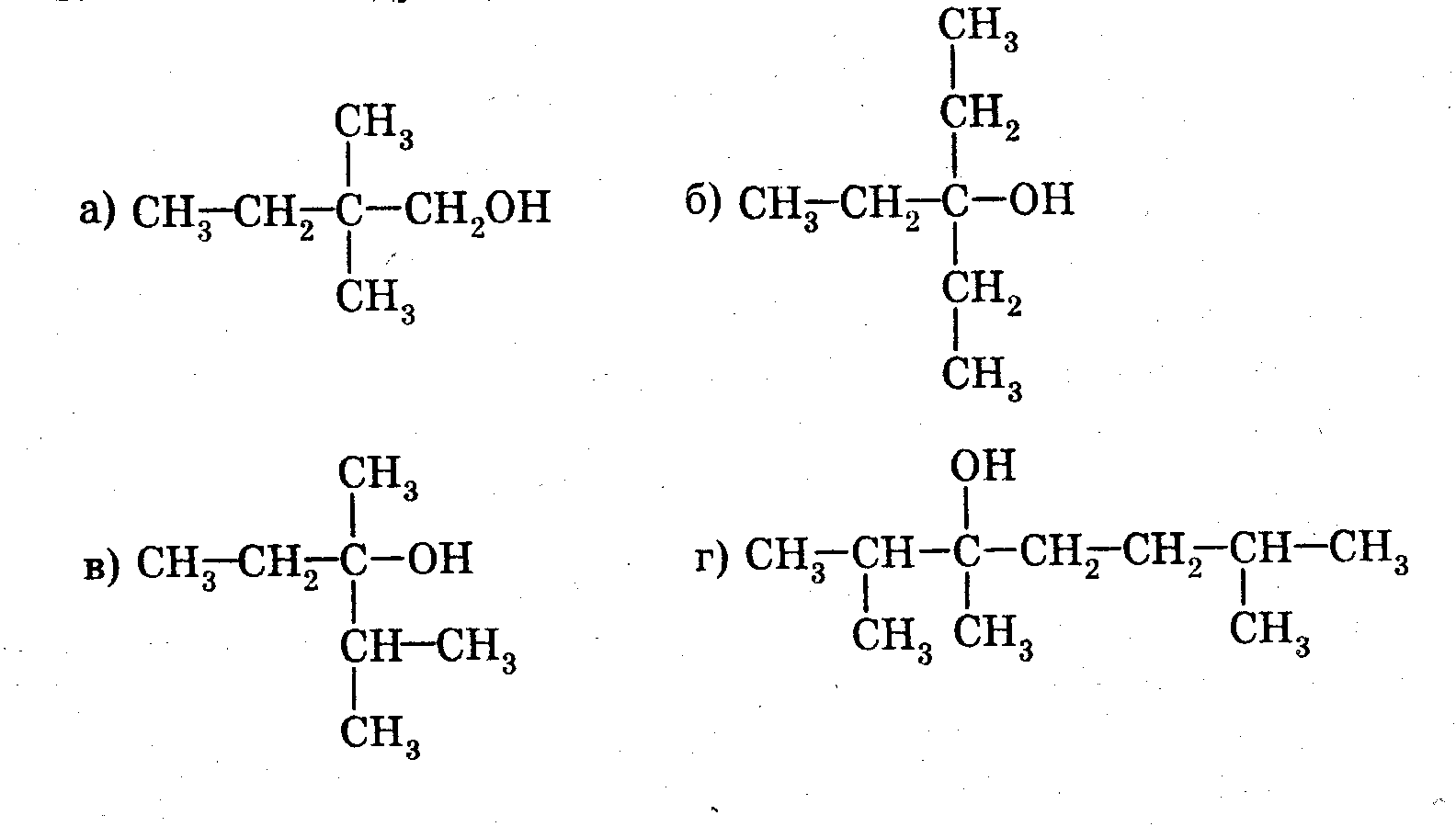Арены
1). 1. Напишите структурные формулы: а) изопропилбензола б) 1,2,3-триметилбензола в) 1-метил-4-этилбензола.
2. Массовые доли углерода и водорода в углеводороде равны соответственно 92,31% и 7,69%. Плотность его паров по водороду составляет 39. Найти молекулярную формулу этого углеводорода.
------------------------------------------------------------------------------------------------------------------------------
2). 1. Составьте формулы четырех изомеров, отвечающих формуле С9Н12 и содержащих бензольное кольцо. Назовите все вещества.
2. Какое количество вещества бензола можно получить тримеризацией 0,3 моль ацетилена.
------------------------------------------------------------------------------------------------------------------------------
3). 1. Назовите вещества:
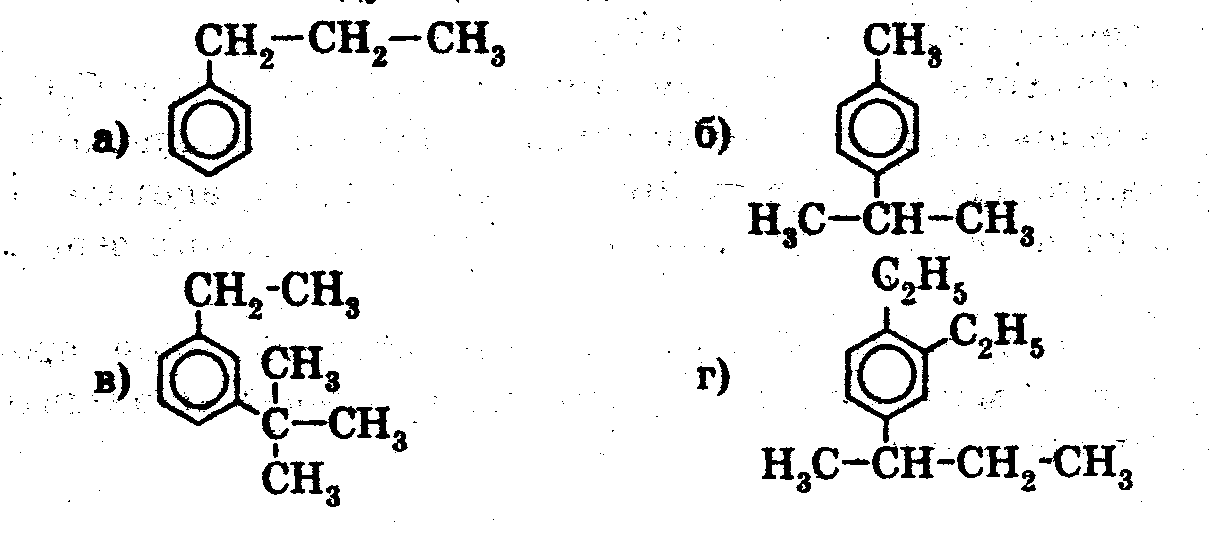
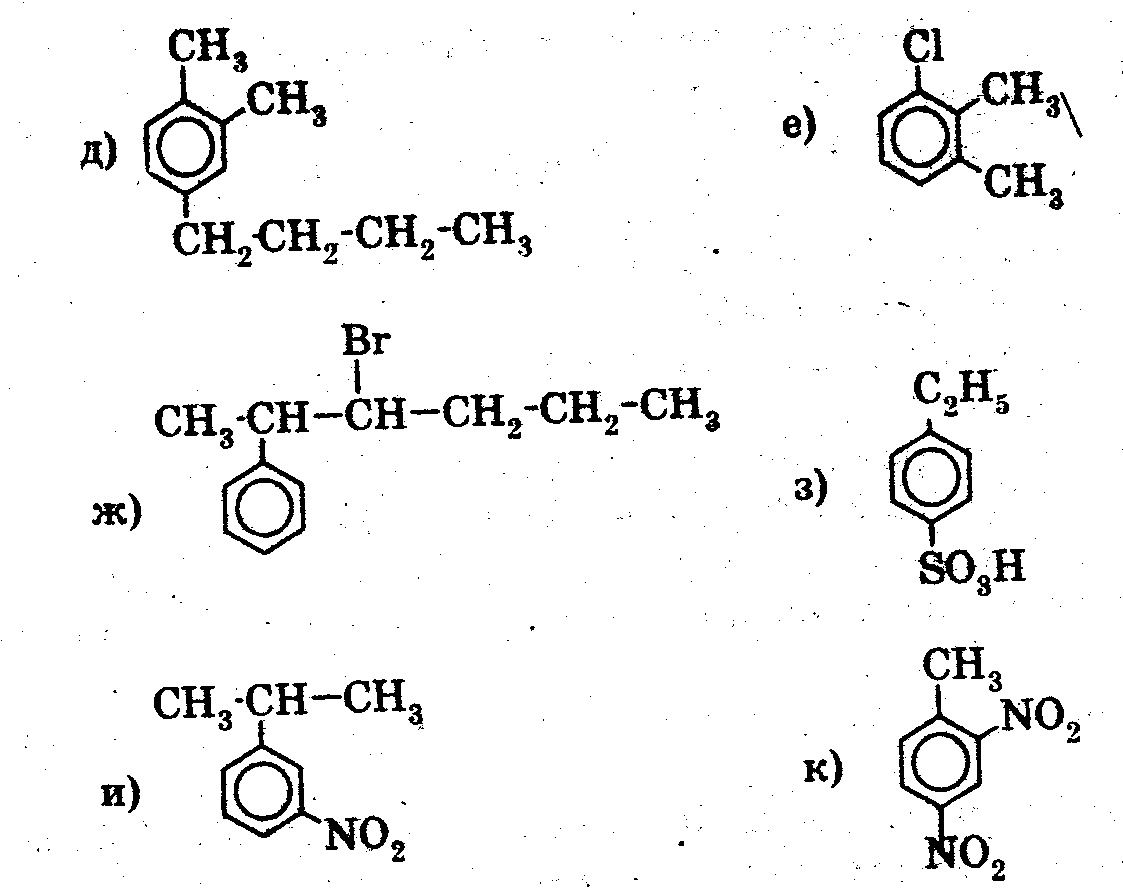
2. Какой объем ацетилена необходим для получения 7,8 г бензола?
------------------------------------------------------------------------------------------------------------------------------
4). 1. Напишите структурные формулы:
а) 1,2-диэтилбензол б) 1-бутил-3-этилбензол в) 4-пропил-2-этилтолуол г) 4-пропил-2-этилтолуол д) 2-бромтолуол е) 1-хлор-2-этилбензол
2. Для протравливания семян зерновых культур применяется гексахлорбензол. Составьте его формулу и вычислите массовые доли элементов в нем в %.
-----------------------------------------------------------------------------------------------------------------------------------5). 1. Напишите уравнения реакций:
а) бензола с хлором в присутствии катализатора; б) толуола с бромом на катализаторе; в) горения толуола г) гидрирования циклогексана.
2. Определить массу нитробензола, полученного нитрованием 15,6 г бензола.
-----------------------------------------------------------------------------------------------------------------------------------
6). 1. Осуществить превращения, формулы органических веществ запишите в структурном виде, назвать вещества:
СН4 → С2Н2 → С6Н6 → С6Н5Сl
2. Из циклогексана массой 9,24 г по реакции дегидрирования получен бензол. Рассчитайте объем бензола, если его плотность равна 0,88 г/мл.
-----------------------------------------------------------------------------------------------------------------------------------
7). 1. Напишите уравнения реакций получения бензола из следующих веществ:
а) ацетилена; б) циклогексана; в) циклогексена; г) н-гексана. Укажите условия протекания реакций.
2. При нитровании бензола массой 78 г получили нитробензол массой 105 г . Какова массовая доля выхода нитробензола в %?
------------------------------------------------------------------------------------------------------------------------------
8). 1. Осуществить превращения, формулы органических веществ запишите в структурном виде:
Метан → ацетилен → бензол → нитробензол
2. Из ацетилена объемом 25 л (н.у.) получен бензол массой 16 г. Какова массовая доля выхода бензола в %?
-----------------------------------------------------------------------------------------------------------------------------------
9). 1. Осуществить превращения, формулы органических веществ запишите в структурном виде, назвать вещества:
CH4 → CH3Br → C2H6 → C2H4 → C2H2 → C6H6
2. Сколько граммов бензола можно получить из 22,4 л ацетилена (Н.У.), если производственные потери составляют 60 %?
-----------------------------------------------------------------------------------------------------------------------
10). 1. Полистирол в отличие от полиэтилена горит коптящим пламенем. Чем это объясняется? Напишите уравнения реакций горения данных веществ.
2. Какой объем бензола (ρ = 0,9 г/см) потребуется для получения 450 г хлорбензола?
-----------------------------------------------------------------------------------------------------------------------------------
11). 1. Напишите уравнения реакций получения ароматических углеводородов из следующих веществ: а) н-гексана б) н-гептана в) 2-метилгексана г) 3,4- диметилгексана. Назовите полученные вещества.
2. Какова масса продукта хлорирования в присутсвии катализатора 130 мл бензола (ρ = 0,9 г/см)?
-----------------------------------------------------------------------------------------------------------------------------------
12). 1. Реакцией алкилирования бензола получите следующие арены: а) метилбензол б) пропилбензол в) изопропилбензол. Напишите реакции горения этих веществ.
2. Какая масса бромбензола образуется при взаимодействии 140,4 мл бензола (ρ = 0,9 г/см) с бромом в присутствии катализатора.
-----------------------------------------------------------------------------------------------------------------------------------
13) 1. Осуществите превращения, формулы органических веществ запишите в структурном виде, назвать вещества:
CH4 → C2H5Cl → C2H4 → C2H4Cl2 → C2H2 → C6H6
2. Сколько граммов продукта образуется при нитровании 55,2 г толуола?
------------------------------------------------------------------------------------------------------------------------------
14). 1. Осуществите превращения, назвать вещества:
С6Н14 → С6Н12 → С6Н6 → С6H5Сl → C6H5CH3 → C6H5CH2Br
2. Какой объем воздуха (н.у.) потребуется для сжигания 39 г бензола.
-----------------------------------------------------------------------------------------------------------------------------------
15). 1. Осуществить превращения:
хлорэтан ← этен ← ацетилен → бензол → бромбензол
2. Найти молекулярную формулу ароматического углеводорода, если при сжигании 3,9 г его образовалось 13,2 г углекислого газа и 2,7 г воды.
------------------------------------------------------------------------------------------------------------------------------
16). 1. Предложите способ получения этилбензола из ацетилена, используя его в качестве единственного органического вещества.
2. Вычислите объем воздуха (н.у.), который потребуется для полного сгорания 1,4-диметилбензола массой 5,3 г.
-----------------------------------------------------------------------------------------------------------------------------------
17). 1. Какие углеводороды образуются при каталитической ароматизации
а) 2,3-диметилгексана б) 3-метилгептана в) н-октана
г) 2-метил-4-хлоргексана.
2). При нитровании толуола массой 46 г получили 92 г 2,4,6-тринитротолуола. Какова массовая доля выхода продукта?
-----------------------------------------------------------------------------------------------------------------------------------
18). 1). Приведите уравнения реакций, характеризующих химические свойства стирола (винилбензола).
2). Какой объем метана (н.у.) потребуется для получения 40 литров бензола (ρ = 0,88 г/мл).
________________________________________________________________________
19).1) Осуществить превращения, назвать вещества:
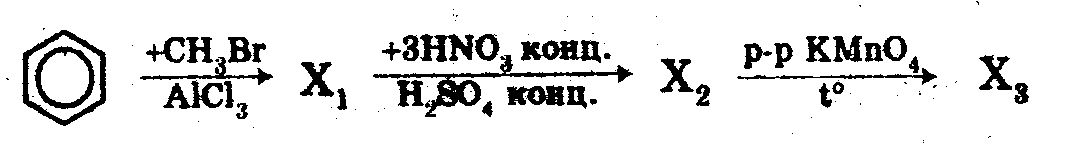
2). Какой объем воздуха потребуется на сжигание 1,3-диметилбензола массой 10,6 г.
------------------------------------------------------------------------------------------------------------------------------
20). 1). Осуществить превращения, назвать вещества:
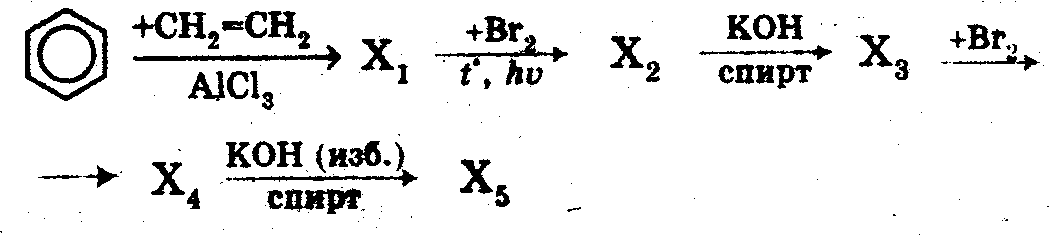
2). Из 6,72 л ацетилена (н.у.) получили 5 мл бензола (ρ = 0,88 г/мл). Рассчитайте массовую долю выхода бензола.
------------------------------------------------------------------------------------------------------------------------------
21)1) Осуществить превращения, назвать вещества:
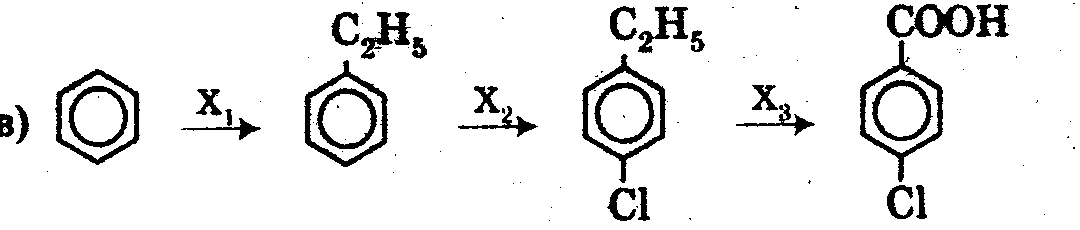
2). Какая масса бензола потребуется для получения нитробензола массой 393,6 г, если массовая доля его выхода составляет 80 %?
-----------------------------------------------------------------------------------------------------------------------------------
22).1) Осуществить превращения:
CH3Cl KMnO4 CH3OH, H+
1-бромпропан → гексан → бензол → Х1 → Х2 → Х3
AlCl3 H2SO4
2) Какую массу гексахлорциклогексана можно получить из бензола массой 31,2 г и хлора объемом 32 л (н.у.)?
------------------------------------------------------------------------------------------------------------------------------
23). 1). Осуществить превращения, назвать вещества:
Pt, t H2O, H+ HBr C6H6, AlCl3 KMnO4
Этан → Х1 → Х2 → Х3 → этилбензол → Х4
H2SO4
2. Рассчитайте, какая масса н-гексана потребуется для из него толуола в процессе ароматизации, чтобы выделившегося при этом водорода было достаточно для гидрирования 84 г гексена-1.
------------------------------------------------------------------------------------------------------------------------------
24). 1) Осуществить превращения, назвать вещества:
Н2О 12000 t, kt CH3Cl Cl2, УФ
Карбид алюминия → Х1 → Х2 → бензол → Х3 → Х4
AlCl3
2. Бензол, полученный дегидрированием циклогексана объемом 151 мл и плотностью 0,88 г/мл, подвергли хлорированию при освещении. Образовалось хлорпроизводное массой 300 г. Определите выход продукта реакции.
-----------------------------------------------------------------------------------------------------------------------------------
25). 1). Осуществить превращения:
Сакт Br2 KOH(спирт) KMnO4
С2Н2 → Х1 → С6Н5-С2Н5 → Х2 → Х3 → Х4
hν Н2О
2). Газ, образовавшийся при сжигании бензола, пропустили через избыток раствора гидроксида бария. Образовался осадок массой 59,1 г . Рассчитайте массу сожженного вещества.