| П  ри работе с концентрированными кислотами нужно соблюдать осторожность, чтобы растворы не попали в глаза, на кожу и одежду. ри работе с концентрированными кислотами нужно соблюдать осторожность, чтобы растворы не попали в глаза, на кожу и одежду. П ри работе с концентрированными кислотами необходимо надевать защитные очки, резиновые перчатки и прорезиненный фартук. ри работе с концентрированными кислотами необходимо надевать защитные очки, резиновые перчатки и прорезиненный фартук. При разведении серной кислоты следует осторожно приливать серную кислоту к воде при тщательном перемешивании во избежание сильного и разбрызгивания. Соляную кислоту можно разбавлять водой без особых предосторожностей, но обязательно в вытяжном шкафу. При обращении с азотной кислотой соблюдаются те же меры предосторожности, что и с серной кислотой. Переливание соляной и азотной кислоты разрешается только под вытяжкой или на воздухе. Необходимо помнить, что концентрированная азотная кислота при действии на органические вещества (скипидар, эфиры, мыла, промасленные тряпки и др.) вызывают воспламенение. С ливать крепкие кислоты в раковины запрещается. Маленькие количества концентрированных кислот и щелочей после их нейтрализации допускается выливать в раковины с последующим промыванием не менее чем 10-кратном размере. ливать крепкие кислоты в раковины запрещается. Маленькие количества концентрированных кислот и щелочей после их нейтрализации допускается выливать в раковины с последующим промыванием не менее чем 10-кратном размере. П опадание крепких кислот на кожу вызывает сильные химические ожоги. опадание крепких кислот на кожу вызывает сильные химические ожоги. При попадании на кожу кислоты необходимо пораженное место тщательно промыть водой и затем нейтрализовать раствором 2 % соды. При попадании на кожу концентрированной серной кислоты нужно обмыть это место большим количеством воды, затем нейтрализовать раствором соды. Кислоты должны храниться в стеклянных склянках с притертыми пробками в прохладном месте. | 





 олучите навеску соли хлорида натрия у мастера.
олучите навеску соли хлорида натрия у мастера. 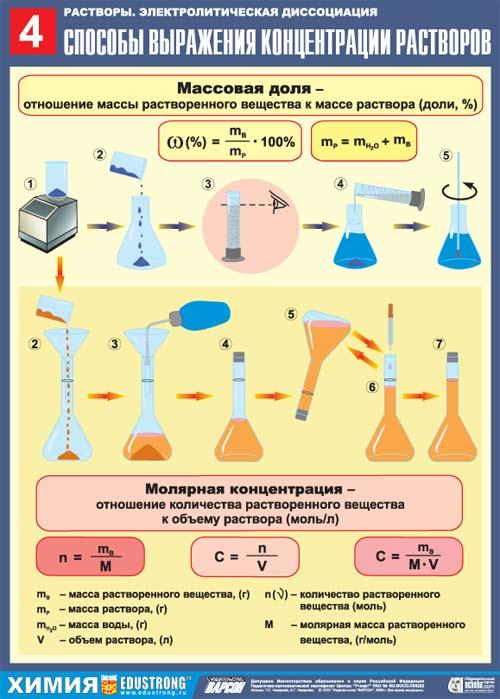
 ри помощи воронки перенести полученную навеску в мерную колбу емкостью 250 мл. Промывалкой обмойте внутреннюю часть воронки небольшим количеством воды. Растворите соль в воде. Затем, добавляя воду небольшими порциями, доведите уровень воды в колбе до метки, закройте колбу пробкой и тщательно перемешайте, переворачивая вверх дном.
ри помощи воронки перенести полученную навеску в мерную колбу емкостью 250 мл. Промывалкой обмойте внутреннюю часть воронки небольшим количеством воды. Растворите соль в воде. Затем, добавляя воду небольшими порциями, доведите уровень воды в колбе до метки, закройте колбу пробкой и тщательно перемешайте, переворачивая вверх дном.  Правило креста". Если в левый угол воображаемого прямоугольника поместить более высокую концентрацию, а в нижний левый – меньшую концентрацию, а в центре - концентрацию получаемого смешанного раствора и затем вычесть по диагонали из большего числа меньшее, то отношение разностей покажет в каком весовом соотношении следует смешать исходные растворы для получения раствора заданной концентрации.
Правило креста". Если в левый угол воображаемого прямоугольника поместить более высокую концентрацию, а в нижний левый – меньшую концентрацию, а в центре - концентрацию получаемого смешанного раствора и затем вычесть по диагонали из большего числа меньшее, то отношение разностей покажет в каком весовом соотношении следует смешать исходные растворы для получения раствора заданной концентрации. 
 24 4
24 4
 10
10 тмерить вычисленные объемы исходных растворов с помощью мерного цилиндра, слить в мерную колбу на 250 мл, довести объем до метки, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном.
тмерить вычисленные объемы исходных растворов с помощью мерного цилиндра, слить в мерную колбу на 250 мл, довести объем до метки, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. 
 ри работе с концентрированными кислотами нужно соблюдать осторожность, чтобы растворы не попали в глаза, на кожу и одежду.
ри работе с концентрированными кислотами нужно соблюдать осторожность, чтобы растворы не попали в глаза, на кожу и одежду. ри работе с концентрированными кислотами необходимо надевать защитные очки, резиновые перчатки и прорезиненный фартук.
ри работе с концентрированными кислотами необходимо надевать защитные очки, резиновые перчатки и прорезиненный фартук. ливать крепкие кислоты в раковины запрещается. Маленькие количества концентрированных кислот и щелочей после их нейтрализации допускается выливать в раковины с последующим промыванием не менее чем 10-кратном размере.
ливать крепкие кислоты в раковины запрещается. Маленькие количества концентрированных кислот и щелочей после их нейтрализации допускается выливать в раковины с последующим промыванием не менее чем 10-кратном размере. опадание крепких кислот на кожу вызывает сильные химические ожоги.
опадание крепких кислот на кожу вызывает сильные химические ожоги. 










