Вариант V
1.Химическая реакция
А) таяние льда В) горение серы
С) плавление сахара D) испарение воды Е) изгибание проволоки
2. Валентность серы в SO2, H2S, Al2S3 соответственно
А) VI, II, III В) II, IV, VI
С) II, III, VI D) IV, II, II Е) II, VI, III
3. Тип реакции: CaCO3 = CaO + CO2
А) разложения В) соединения
С) обмена D) замещения Е) дегидрирования
4. Для реакции с 3 моль кислорода необходим кальций массой
А) 40г В) 200г
С) 240г D) 120г Е) 80г
5.Кислотный, основной, амфотерный оксиды соответственно в группе
А) FeO, Al2O3, SO3 В) Al2O3, SO3, CaO
С) SO3, Al2O3, CaO D) CaO, Al2O3, SO3 Е) SO3, CaO, Al2O3
6. О простом веществе идёт речь в выражении
А) водород входит в состав воды В) водород горит в кислороде
С) водород входит в состав кислот D) химический знак водорода Н
Е) водород расположен в первой группе периодической таблицы
7. Формула двухосновной кислородсодержащей кислоты
А) HNO3 В) HCl
С) H3PO4 D) H2SO4 Е) H2S
8. Формула кислой соли
А) NaNO3 В) KCl
С) NaH2PO4 D) FeSO4 Е) Li2S
9. 45г воды составляют
А) 3 моль В) 2 моль
С) 2,5 моль D) 3,5 моль Е) 1,5 моль
10. Вода взаимодействует со всеми веществами группы
А) CaO, Cu, SO2 В) SO3, Cu, FeO
С) SO2, Na2O, Ca D) Ag, K2O, SO3 Е) BaO, SiO2, Na
11. Для реакции с 15,2г сульфата железа(II) необходим гидроксид натрия массой
А) 8г В) 9г
С) 5,6г D) 4г Е) 14,2г
12. Формула вещества Х в схеме превращении Fe  FeCl2
FeCl2  X
X 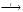 FeO
FeO
А) Fe(OH)3 В) FeCl3
С) Fe D) Fe (NO3)2 Е) Fe(OH)2
13. Ряд чисел 2,8,2 соответствуют распределению электронов по энергетическим уровням атома
А) Al В) Mg
С) P D) Cl Е) Si
14. Число нейтронов в ядре атома брома 80Br
А) 32 В) 45
С) 25 D) 80 Е) 35
15. Число электронов на внешнем энергетическом уровне атома магния
А) 1 В) 2
С) 3 D) 8 Е) 6
16. Число нейтронов в ядре атома определяется по формуле
А) N=Z-Ar В) N= Ar- Z
С) N=NA∙ υ D)  Е) N=n
Е) N=n
17. Ионная связь в молекулах всех веществ группы
А) НCl, Cl2, CaCl2 В) Cl2, NH3, P2О5
С) CaCl2, NaBr, KF D) NH3, SiO2, NaBr Е) P2О5, N2, KF
18. Степень окисления серы в сульфите калия K2SO3
А) +1 В) +2
С) -2 D) +4 Е) -4
19. В две ступени диссоциирует
А) HCl В) H3PO4
С) HNO3 D) H2SO4 Е) Na2CO3
20. Сокращённое ионное уравнение:Cu2+ + 2OH- = Cu (OH)2 соответствует взаимодействию
А) CuCO3 + 2NaOHà В) CuS+ 2KOHà
С) CuSiO3 + LiOHà D) CuCl2 + Fe(OH)2à Е) Cu(NO3)2 + 2NaOHà
21. Электронная формула неметалла
А) 1s22s22p63s1 В) 1s22s22p63s2
С) 1s22s22p63s23p5 D) 1s22s22p63s23p1 Е) 1s22s1
22. Число молекул в 40г брома Br2
А) 6∙1023 В) 6∙1022
С) 2,5∙1023 D) 1,5∙1023 Е) 3∙1022
23. Массовая доля серы в оксиде серы (VI)
А) 50% В) 25%
С) 40% D) 80% Е) 65%
24. При взаимодействии 32 г меди с 32 г серы образуется сульфид меди (II) массой
А) 28 г В) 48 г
С) 38 г D) 58 г Е) 68 г
25. Вещество Х в схеме превращений P X
X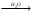 Н3ЭО4
Н3ЭО4
А) P2O3 В) P2O5
С) Na3PO4 D) PH3 Е) PCL5
26. Сумма коэффициентов в уравнении реакции горения угарного газа CO
А) 3 В) 4
С) 5 D) 6 Е) 7
27. Вещество, формула которого С6Н6, относится к классу:
A) алканов B) алкенов
C) алкинов D) Аренов E) алкадиенов
28. Гомологом пентена – 1 является:
A) пентен – 2 B) метан
C) гексен -1 D) бутан E) бутен -2
29. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n +2, является реакция:
A) замещения B) гидрирования
C) присоединения D) дегидратации E) гидролиза
30. Углеводород, массовая доля водорода в котором 15,79 %, имеющий относительную плотность по воздуху 3,93 , это:
A) С8Н18 B) С6Н14
C) С8Н16 D) С6Н12 E) С7Н16







 FeCl2
FeCl2  X
X 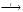 FeO
FeO Е) N=n
Е) N=n X
X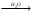 Н3ЭО4
Н3ЭО4















