Используя систему укрупнения дидактических единиц (УДЕ) академика П.М. Эрдниева, как технологию изучения взаимосвязанных понятий, можно решить проблему лимита учебного времени на изучение данной темы.
Лейтмотивом урока, построенного по системе УДЕ, служит правило : не повторение, отложение на следующие уроки, а преобразование выполненного задания, осуществляемое немедленно на этом уроке, через несколько секунд или минут после исходного, чтобы познавать объект в его развитии, противопоставить исходную форму знания видоизмененной.
Учащимся предлагается:
а) изучать одновременно взаимно обратные действия и операции;
б) сравнивать противоположные понятия, рассматривая их одновременно;
в) сопоставлять родственные и аналогичные понятия;
г) сопоставлять этапы работы над упражнением, способы решения.
Просмотр содержимого документа
«ИЗОПРОЦЕССЫ В ГАЗАХ»

Изопроцессы в газах
Физика, 10 класс.
Учитель: Момолдаева Раиса Горяевна

ПОВТОРЕНИЕ
1 . Из математики: графики функций

ПОВТОРЕНИЕ
2. Макроскопическое тело?
3. Внутреннее состояние макроскопических тел определяется макроскопическими параметрами .....
- ДАВЛЕНИЕ газа объясняется ударами молекул о стенки сосуда
- Газ занимает весь предоставленный ему ОБЪЕМ
- ТЕМПЕРАТУРА мера средней кинетической энергии молекул

ПОВТОРЕНИЕ
4. Основное уравнение МКТ идеального газа
5. Уравнение состояния идеального газа
6. Газовые законы ( дать определение)

Газовые законы
Зависимость между двумя параметрами газа определенной массы при фиксированном значении третьего называют газовым законом.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами ( «изос» - равный )

ИЗОПРОЦЕССЫ

ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
– изменения состояния газа при постоянной температуре (Т = const )
p 1 V 1 = p 2 V 2
Закон Бойля – Мариотта : для газа данной массы произведение давления газа на его объём постоянно, если температура газа не изменяется.
Примеры : дыхание человека, медленное сжатие мяча

ГРАФИКИ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА


ГРАФИКИ ИЗОТЕРМИЧЕСКОГО РАСШИРЕНИЯ

ИЗОБАРНЫЙ ПРОЦЕСС
– изменение состояния газа при постоянном давлении (р = const )
Закон Гей – Люссака: для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется
Примеры : раширение газа в цилиндре под поршнем

ГРАФИКИ ИЗОБАРНОГО ПРОЦЕССА

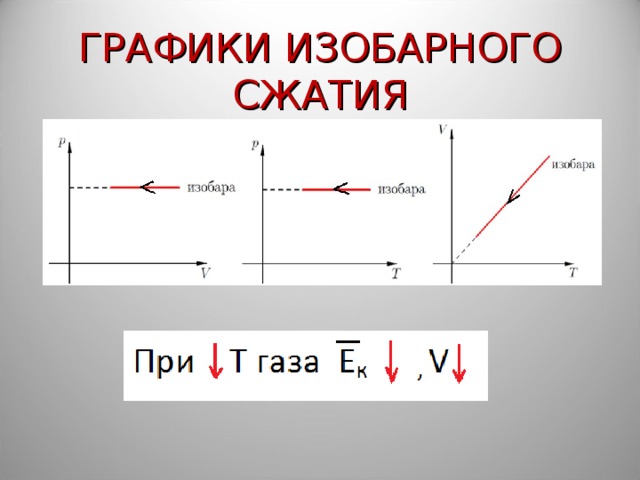
ГРАФИКИ ИЗОБАРНОГО СЖАТИЯ

ИЗОХОРНЫЙ ПРОЦЕСС
– изменение состояния газа при постоянном объёме ( V = const)
Закон Шарля: для газа данной массы отношение давления к температуре постоянно, если объём не меняется
Пример : нагревание лампы

ГРАФИКИ ИЗОХОРНОГО ПРОЦЕССА


ГРАФИКИ ИЗОХОРНОГО НАГРЕВАНИЯ

1. Сравнить постоянные параметры для двух изопроцессов

2. Какие процессы представлены на графике и как изменяются параметры газа?

2 . Вычертить диаграмму в других координатах

Завершить заполнение таблицы по трем обратным процессам и сдать листы на проверку
Дом. задание: § 68,69.
Описать процессы
замкнутого цикла и
вычертить диаграмму
в других координатах





































