ТЕХНОЛОГИЧЕСКСЯ КАРТА ЗАНЯТИЯ
| Преподаватель | Глухоедова Е.П. |
| Группа | ЭМ-11 |
| Тема урока : | Изучение взаимодействия металлов с растворами кислот и солей. |
| Тип урока : | Урок совершенствования ЗУН. |
| Форма урока: | Практическая работа |
| Цели урока: | Образовательные | -используя внутри и межпредметные связи, лабораторный эксперимент, совершенствовать знания о способности металлов взаимодействовать с растворами кислот и солей; - определить взаимосвязи химических свойств металлов со строением их атомов. |
| Развивающие | - формирование навыков анализировать и делать выводы на основеконкретного химического эксперимента; - формирование научного типа мышления, владения химической терминологией; - продолжить развитие навыков составления реакций ионного обмена и ОВР на примере химических свйств металлов; - продолжить формирование у учащихся способности к самостоятельной образовательной, учебно-исследовательской деятельности, навыков разрешения проблем. |
| Воспитательные | - продолжить формирование умения продуктивно общаться и взаимодействовать со сверстниками в процессе совместной деятельности; а также формирование навыков аккуратного ведения лабораторного журнала.
|
| Методы и приёмы обучения:
Комплексно-методическое обеспечение: | Методы словесной передачи и слухового восприятия информации (приемы: лекция, беседа); Методы наглядной передачи и зрительного восприятия информации (приемы: наблюдение, демонстрация); Методы контроля (приемы: фронтальный опрос, самостоятельная работа). |
Доска; Периодическая таблица химических элементов Д.И. Менделеева,ряд активности металлов; Таблица растворимости; Компьютер; Мультимедийный проектор; Экран; «Виртуальная лаборатория»; Саенко О.Е. Химия для колледжей: учебник. – Ростов-на- Дону: Феникс, 2014г. Раздаточный материал.
|
Ход занятия
| Задачи данного этапа урока | Деятельность преподавателя | Деятельность учащихся |
| I. Организационный этап 2-3 мин |
| Мотивация к активной познавательной деятельности
| Приветствие. Выявление отсутствующих. Сообщение темы и постановка цели урока . |
Записывают тему урока . |
| II. Актуализация знаний 10-15 мин |
| Используя межпредметные связи (физика), сформировать представление о зависимости физических свойств металлов от их строения.
- формирование научного типа мышления, владения химической терминологией.
| Прежде чем изучать химические свойства металлов, давайте вспомним закономерности в строении атомов металлов и общие физические свойства металлов. Преподаватель раздает по одному тексту с вопросами на каждый ряд. В каждом тексте по 4 вопроса (на 4 группы) Задача – ответить на предложенные вопросы.
Задание 1-й группы (ряда) – закончить данные предложения.
Задание 2-й группы (ряда) – ответить на предложенные вопросы
Задание 3-й группы (ряда) – ответить на предложенные вопросы
Вывод: - Благодаря металлической связи и металлической кристаллической решетке, металлы обладают общими физическими свойствами. Перечислите эти свойства. |
Учащиеся в паре, отвечают на свой вопрос, передают ответ вперёд, первая парта зачитывает ответы ответы. Отвечают на вопросы: 1. Если провести диагональ в ПСХЭ Д. И. Менделеева от бора к астату, то в левом нижнем углу будут находиться …(металлы) 2. У металлов на внешнем энергетическом уровне находится небольшое количество электронов (1-2, реже 3-4 электрона) 3. Радиус атомов металлов сравнительно (большой). 4. Металлические свойства с увеличением порядкового номера в периодах ослабевают, а в группах сверху вниз усиливаются.
Отвечают на вопросы: 1. Тип химической связи в металлах? (металлическая) соответственно тип кристаллической решетки в металлах называется (металлической). 2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны) 3.Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия называется (Пластичность) 4.Какую плотность имеют легкие металлы ? (Плотность менее 5 г/см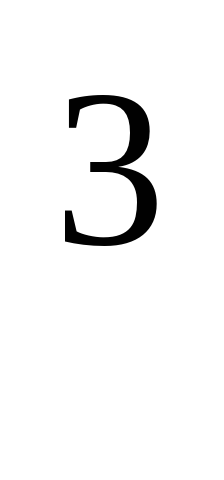 ).Самый легкий металл? (Литий) ).Самый легкий металл? (Литий)
Отвечают на вопросы: 1.Металлическая связь обусловлена наличием (свободных) электронов. 2.Лучшие проводники электричества среди металлов? (Серебро, медь) 3.Какую температуру плавления имеют тугоплавкие металлы? ( Т плавл. более 1000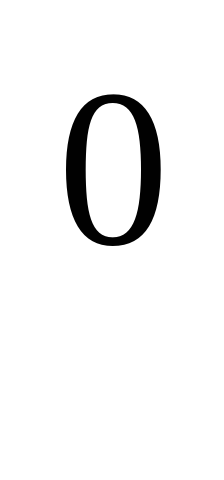 С). Самый тугоплавкий металл? (Вольфрам). С). Самый тугоплавкий металл? (Вольфрам). 4. Свойство поверхностью металла отражать световые лучи называется? (Металлический блеск)
Фронтально перечисляют основные физические свойства металлов.
|
| III. Совершенствование знаний, умений и навыков ( в рамках проведения практической работы)- основной этап урока 35-45мин |
|
- формирование научного типа мышления, владения химической терминологией.
-формиров ание навыков наблюдения и описания химических реакций с помощью естественного (русского, родного) языка и языка химии. - формирование навыков проводить химический эксперимент - формирование навыков описания свойств металлов на основе наблюдений за их превращениями; - формирование навыков анализировать и делать выводы.
-формирование навыков составления уравнений реакций, подтверждающих химические свойства металлов
| Учитель проговаривает основные задачи урока (принцип целеполагания): Мы должны к заключению урока: -знать общие химические свойства металлов; -уметь записывать уравнения реакций, характеризующие особые химические свойства металлов; -наблюдать, анализировать и прогнозировать химический эксперимент; -получить навыки осуществления цепочек хим. превращений. Часть 1. Экспериментальный этап Преподаватель демонстрирует видеоэксперименты особенности взаимодействия различных металлов с кислотами и солями. ,характеризующие реакции взаимодействия Опыт №1. Взаимодействие металлов с кислотами
Опыт №2. Взаимодействие металлов с растворами солей
Часть 2. Этап первичного применения полученных ЗУН Групповая работа Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: С→СО2→MgCO3→MgO→Mg(NO3)2→ Mg(OH)2→ MgO |
1.Анализируют ход опыта, делают выводы. 2.Описывают предложенный эксперимент. 3.Записывают в бланках уравнения соответствующих реакций. 4.Решают проблему, поясняя: с учетом правил по положению металлов в ряду напряжений: Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt Au 1.Активность металлов определяется по способности их вытеснять водород из состава кислот в зависимости от местонахождения металла в ряду (работа с таблицей «Электрохимический ряд напряжений металлов»). с учетом правил по положению металлов в ряду напряжения Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt Au 2.Наиболее активные металлы вытесняют менее активные из их солей (работа с таблицей «Электрохимический ряд напряжений металлов»).
Запись уравнений химических реакций согласно предложенной схеме- работа на месте, фронтально у доски
|
| IV. Закрепление и обобщение полученных знаний. 10-15мин |
| - формирование навыков применять полученные знания, анализировать и делать выводы
V. Подведение итогов (рефлексия) 4-5 минут - формирование навыков анализировать и делать выводы, подводить итоги
| На этапе закрепления студентам предлагается выполнение индивидуальной работы по изучению химических свойств металлов. Индивидуальные задания: Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Вариант 1 Fe → FeCl2→ FeCl3→ Fe(OH)3→ Fe2(SO4)3 →Fe(NO3)3 Вариант 2 Cu→ CuO→ CuSO4 → Cu(OH)2→ CuO→ Cu Вариант 3 Са → Са(ОН)2→ СаСО3→ СаО → Са(ОН)2 → СаCl2→ Са Вариант 4 Аl2O3 → Аl → AlCl3→Al(OH)3→Al(NO3)3→ Al(OH)3
Фронтальная беседа, приём-кубик Блума
| Выполнение работы по изучению химических свойств металлов с использованием инструкций (выполнение индивидуального задания на бланке)
Ответы на вопросы преподавателя в игровой форме.
|
| VI. Домашнее задание. 3-5 мин |
| - продолжить формирование у учащихся способности к самостоятельной образовательной, деятельности.
| Пояснения к домашнему заданию: 1.Подготовить отчёт по работе 2.ЗАПОМНИТЬ! Химические свойства металлов 3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.: Fe2О3 → Fe→ Fe SO4→ Fe(OH)2→ Fe(OН)3 ↓ Fe (SO4)3→Fe(OН)3
| Записывают задание. |
Приложения.
Приложение 1. Задания для групп.
Приложение 2. Инструктивная карта практической работы.
Приложение 1.
Закончите фразу:
1. Если провести диагональ в ПСХЭ Д. И. Менделеева от бора к астату, то в левом нижнем углу будут находиться …(металлы)
2. У металлов на внешнем энергетическом уровне находится небольшое количество электронов
(1-2, реже 3-4 электрона)
3. Радиус атомов металлов сравнительно (большой).
4. Металлические свойства с увеличением порядкового номера в периодах ослабевают, а в группах сверху вниз усиливаются.
Дайте ответ на вопрос:
1. Тип химической связи в металлах? (металлическая) соответственно тип кристаллической решетки в металлах называется (металлической).
2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны)
3.Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия называется (Пластичность)
4.Какую плотность имеют легкие металлы ? (Плотность менее 5 г/см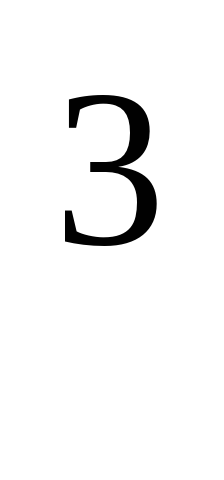 ).Самый легкий металл? (Литий)
).Самый легкий металл? (Литий)
Дайте ответ на вопрос:
1.Металлическая связь обусловлена наличием (свободных) электронов.
2.Лучшие проводники электричества среди металлов? (Серебро, медь)
3.Какую температуру плавления имеют тугоплавкие металлы?
( Т плавл. более 1000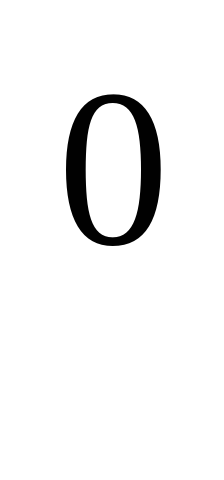 С). Самый тугоплавкий металл? (Вольфрам).
С). Самый тугоплавкий металл? (Вольфрам).
4. Свойство поверхностью металла отражать световые лучи называется? (Металлический блеск)
Приложение 2.
Практическая работа № 8 (инструктивная карта)
Тема: Изучение взаимодействия металлов с растворами кислот и солей.
Цель: (студент формулирует самостоятельно)
Оборудование: инструктивные карты
Ход работы
Часть 1
Опыт №1. Взаимодействие металлов с кислотами
Реактивы и оборудование: Магний, Аl (гранулы), железо , Zn (гранулы), 40%-ый раствор НCl; пробирки.
В три пронумерованные пробирки нальем 3 мл 40%-го раствора НCl и поместим в каждую гранулы магния, железа и алюминия, соответственно. В маленький кристаллизатор нальём небольшое количество 40%-го раствора НCl .
Наблюдения:
- в пробирке с магнием:
HCl + →
- в пробирке с железом:
HCl + →
- в пробирке с алюминием:
HCl + →
Проблема: все взятые металлы активны, однако они по-разному реагируют с водой?
Пояснение:
Вывод по опыту:
Опыт №2. Взаимодействие металлов с растворами солей
Реактивы и оборудование: Zn (гранулы), Fe (железный гвоздь), (40%-ый раствор сульфата железа (II), пробирки.
В пробирку № 1 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим кусочек железа (железный гвоздь). В пробирку № 2 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим гранулу цинка.
Проблема:Все предложенные опыты – это опыты с использованием металла и соли другого металла, напишите уравнения реакции согласно предлож. эксперименту. Опишите наблюдения.
В колбе № 1: СuSO4 + Fe →
В колбе № 2: СuSO4 + Zn →
Вывод по опыту:
Часть 2
Задание 1. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С→СО2→MgCO3→MgO→Mg(NO3)2→ Mg(OH)2→ MgO
Индивидуальные задания:
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Вариант 1
Fe → FeCl2→ FeCl3→ Fe(OH)3→ Fe2(SO4)3 →Fe(NO3)3
Вариант 2
Cu→ CuO→ CuSO4 → Cu(OH)2→ CuO→ Cu
Вариант 3
Са → Са(ОН)2→ СаСО3→ СаО → Са(ОН)2 → СаCl2→ Са
Вариант 4
Аl2O3 → Аl → AlCl3→Al(OH)3→Al(NO3)3→ Al(OH)3
Задание на дом:
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.:
Fe2О3 → Fe→ Fe SO4→ Fe(OH)2→ Fe(OН)3
↓
Fe (SO4)3→Fe(OН)3
9