Просмотр содержимого документа
«Химические формулы 8 класс»
Химия – через волшебную трубу
Химические формулы
8 класс
Создатель: Гираев Н.С. учитель химии высшей категории
МКОУ «Сертильская СОШ» Табасаранского района Республики Дагестан
2020 г
«Неорганические»
Создатель: Гираев Н.С.
учитель химии
МКОУ «Сертильская СОШ»
Республика Дагестан
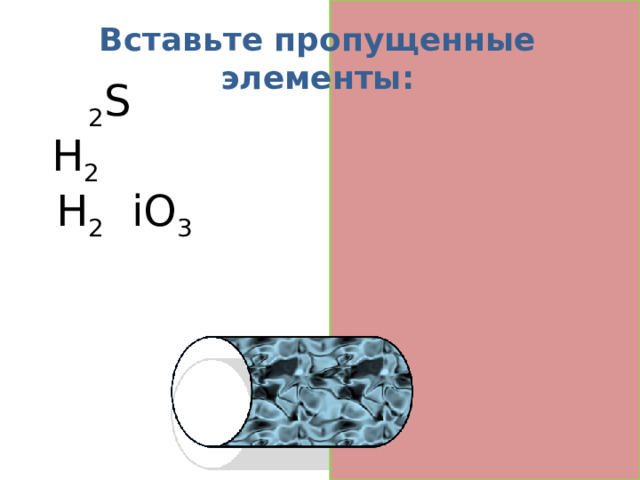
Вставьте пропущенные элементы:
H 2 S
H 2 O
H 2 S iO 3

Вставьте пропущенные буквы:
а т ом
м о ле к у л а
п р от о н
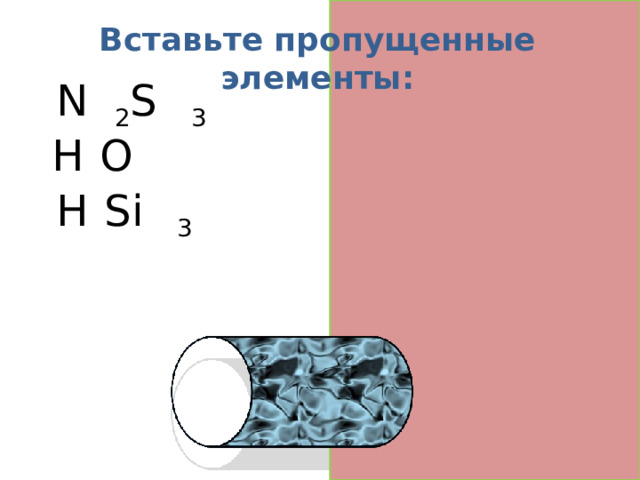
Вставьте пропущенные элементы:
N a 2 S O 3
H 2 O
H 2 Si O 3
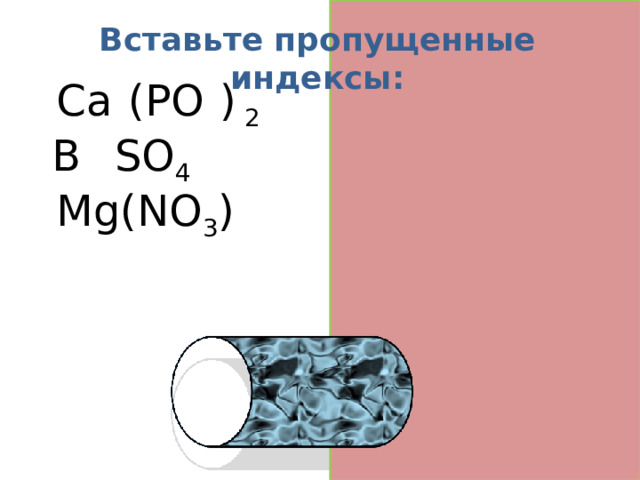
Вставьте пропущенные индексы:
Ca 3 (PO 4 ) 2
B a SO 4
Mg(NO 3 ) 2
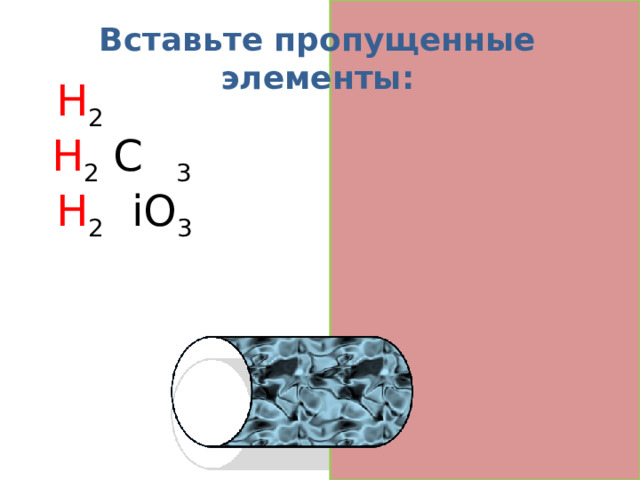
Вставьте пропущенные элементы:
H 2 S
H 2 C O 3
H 2 S iO 3
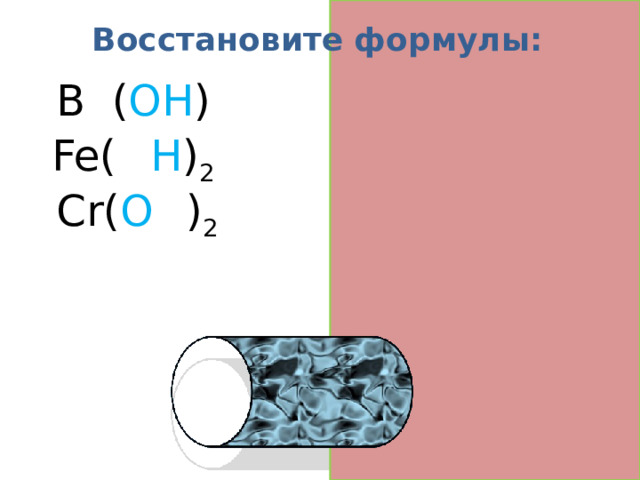
Восстановите формулы:
B a ( OH ) 2
Fe( O H ) 2
Cr( O H ) 2
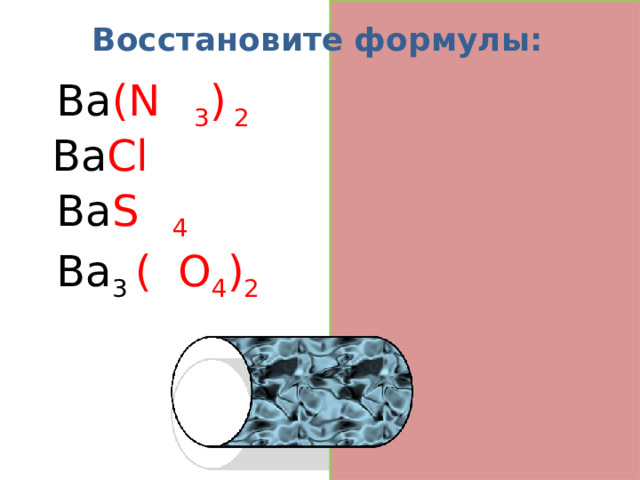
Восстановите формулы:
Ba (N O 3 ) 2
Ba Cl 2
Ba S O 4
Ba 3 ( P O 4 ) 2
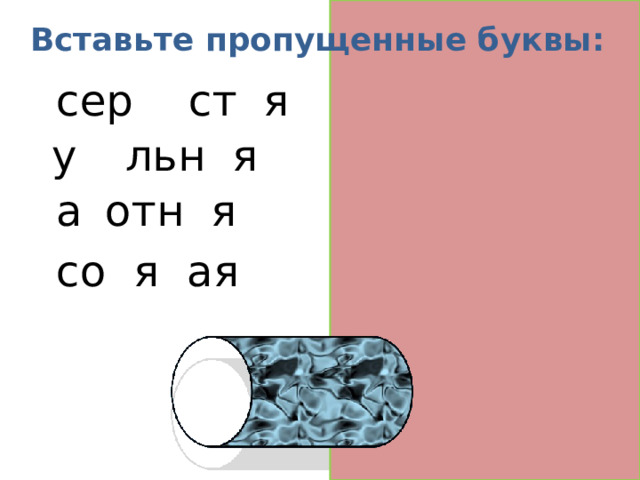
Вставьте пропущенные буквы:
сер ни ст а я
у го льн а я
а з отн а я
со л я н ая
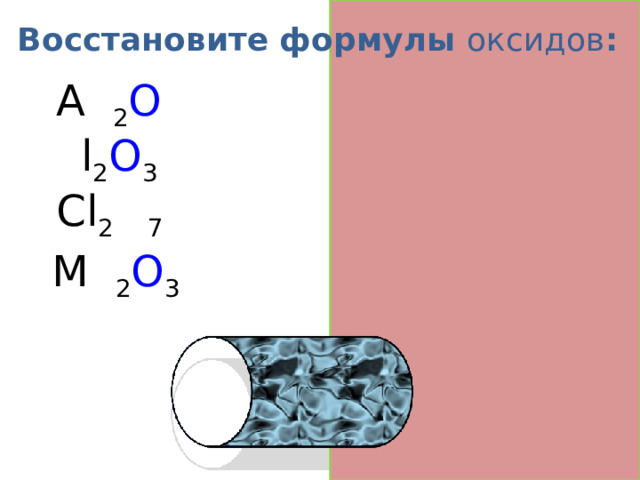
Восстановите формулы оксидов :
A g 2 O
A l 2 O 3
Cl 2 O 7
M n 2 O 3
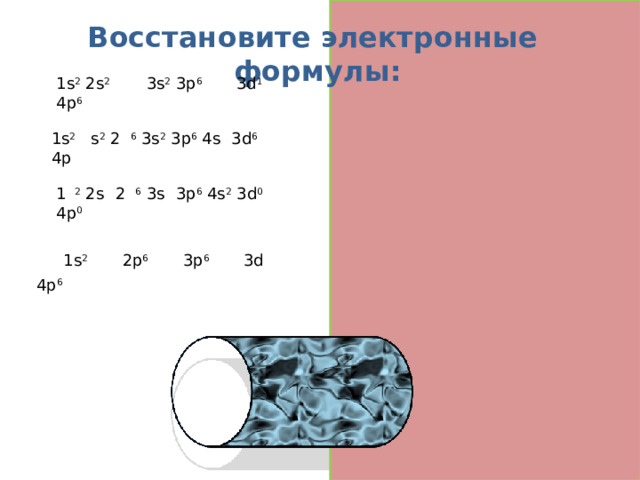
Восстановите электронные формулы:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 4p 6
1s 2 2 s 2 2 p 6 3s 2 3p 6 4s 2 3d 6 4p 0
1 s 2 2s 2 2 p 6 3s 2 3p 6 4s 2 3d 0 4p 0
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
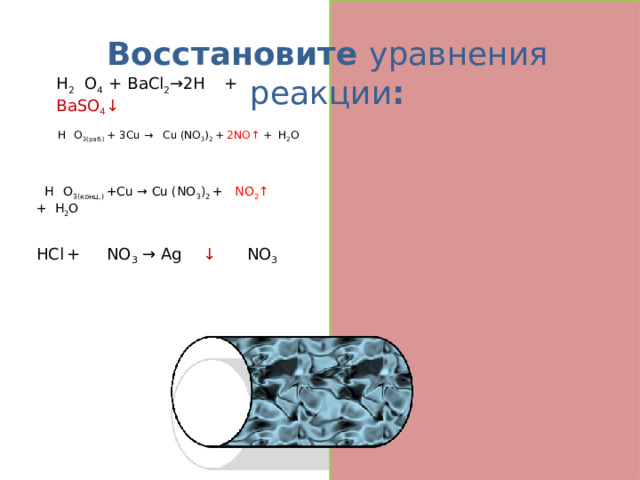
Восстановите уравнения реакции :
H 2 S O 4 + BaCl 2 →2H Сl + BaSO 4 ↓
8 H N O 3(раб.) + 3Cu → 3 Cu l (NO 3 ) 2 + 2NO↑ + 4 H 2 O
4 H N O 3(конц.) +Cu → Cu l (NO 3 ) 2 + 2 NO 2 ↑ + 2 H 2 O
HCl + Ag NO 3 → Ag Cl ↓ + H NO 3
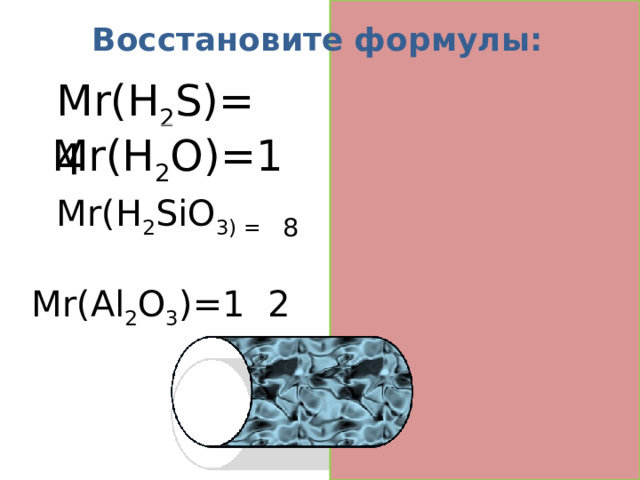
Восстановите формулы:
Mr(H 2 S)= 3 4
Mr(H 2 O)=1 8
Mr(H 2 SiO 3) = 7 8
Mr(Al 2 O 3 )=1 0 2
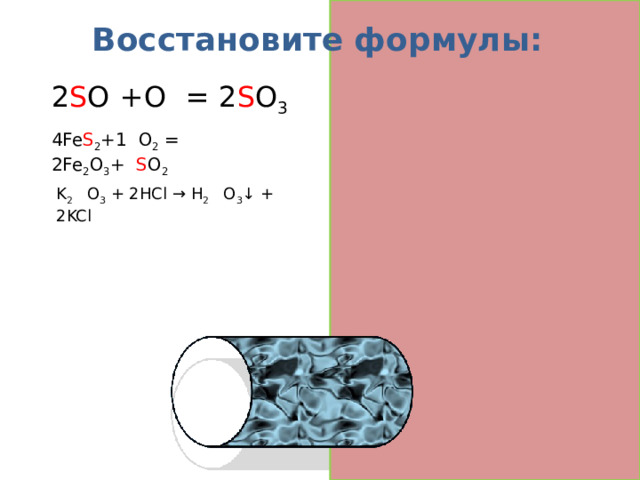
Восстановите формулы:
2 S O 2 +O 2 = 2 S O 3
4Fe S 2 +1 1 O 2 = 2Fe 2 O 3 + 8 S O 2
K 2 Si O 3 + 2HCl → H 2 Si O 3 ↓ + 2KCl
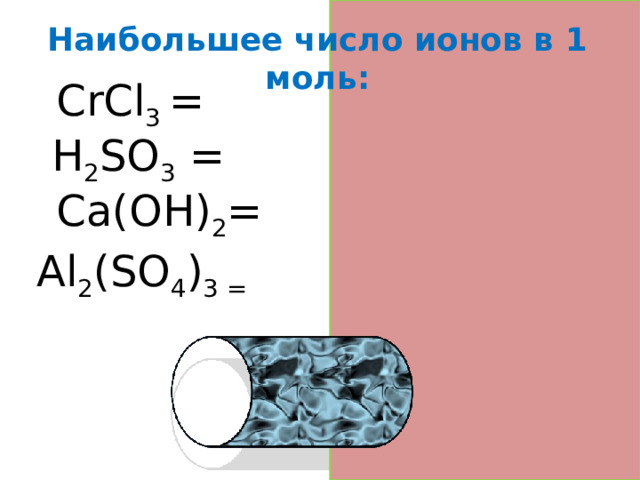
Наибольшее число ионов в 1 моль :
CrCl 3 = 4
Н 2 SО 3 = 3
Cа(OH) 2 = 3
Al 2 (SO 4 ) 3 = 5
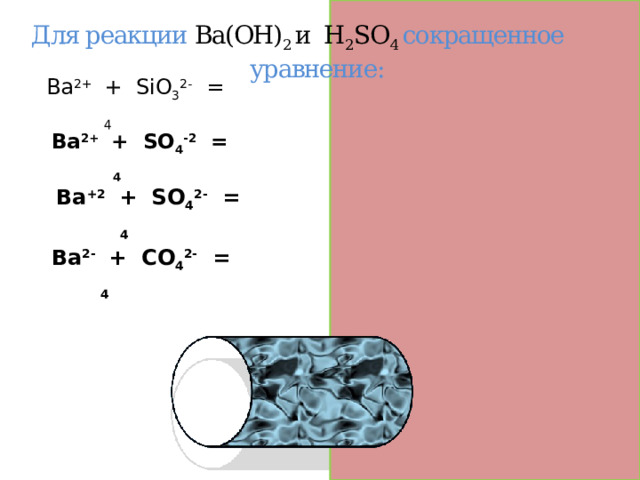
Для реакции Ва(OH) 2 и H 2 SO 4 сокращенное уравнение:
Ва 2+ + SiO 3 2- = ВаSO 4
Ва 2+ + SO 4 -2 = ВаSO 4
Вa +2 + SO 4 2- = ВаSO 4
Ва 2- + CO 4 2- = ВаSO 4
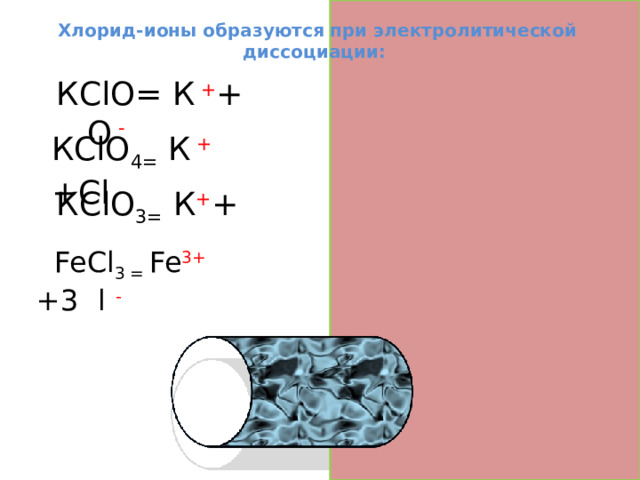
Хлорид-ионы образуются при электролитической диссоциации:
КClО= К + + Cl О -
КClО 4= К + +Cl О -
КClО 3= К + + ClО -
FeСl 3 = Fe 3+ +3 C l -
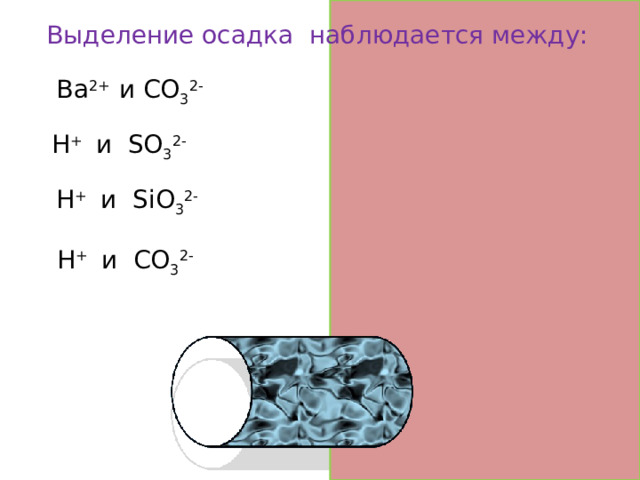
Выделение осадка наблюдается между:
Ba 2+ и CO 3 2- да
H + и SO 3 2- нет
H + и SiO 3 2- да
H + и CO 3 2- нет
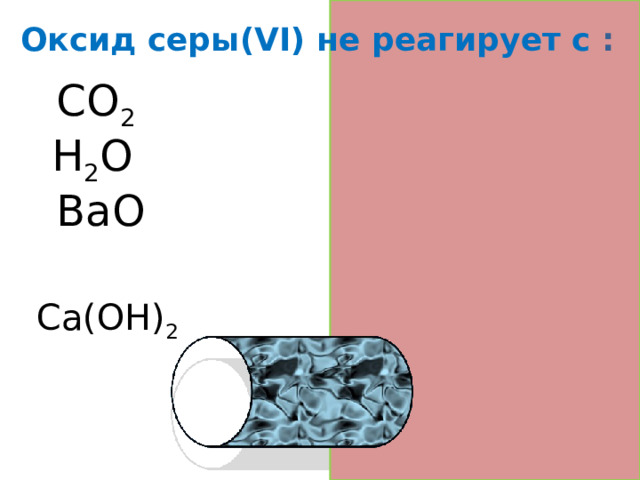
Оксид серы(VI) не реагирует с :
CO 2
H 2 O +SO 3
BaO +SO 3
Ca(OH) 2 +SO 3
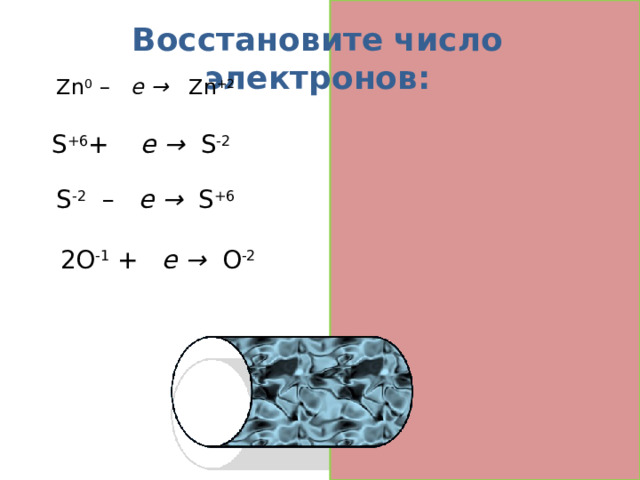
Восстановите число электронов:
Zn 0 – 2 е → Zn +2
S +6 + 8 е → S -2
S -2 – 8 е → S +6
2О -1 + 2 е → О -2
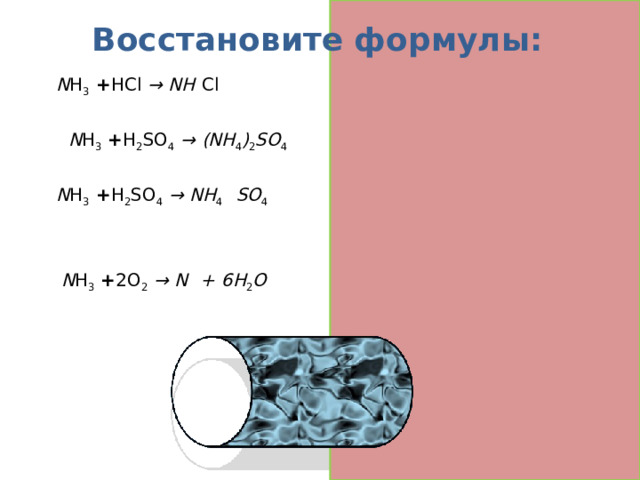
Восстановите формулы:
N H 3 + HCl → NH 4 Cl
2 N H 3 + H 2 SO 4 → (NH 4 ) 2 SO 4
N H 3 + H 2 SO 4 → NH 4 H SO 4
4 N H 3 + 2O 2 → N 2 + 6H 2 O
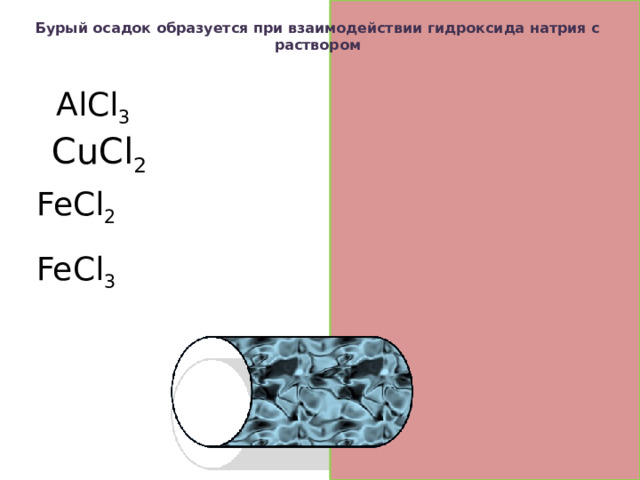
Бурый осадок образуется при взаимодействии гидроксида натрия с раствором
AlCl 3 белый
CuCl 2 голубой
FeCl 2 светло-зеленый
FeCl 3 бурый
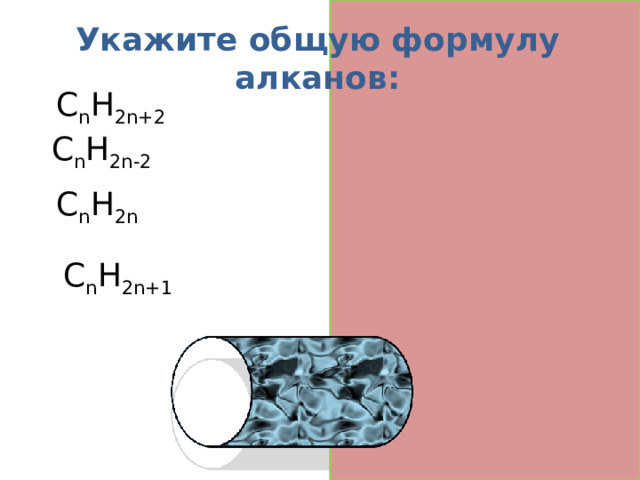
Укажите общую формулу алканов:
C n H 2n+2 алканы
C n H 2n-2 алкины
C n H 2n алкены
C n H 2n+1 радикалы
C
C
Гираев Н.С.
C
C
C
C








































