Просмотр содержимого документа
«Химические уравнения»

8 класс
ХИМИЧЕСКИЕ УРАВНЕНИЯ
Бозаджи Н.М.
учитель химии
высшей категории

В результате изучения темы ,вы будете способны:
1.Давать определения понятиям: химическая реакция, химическое уравнение, исходные вещества, продукты реакции, коэффициент.
2.Применять закон сохранения массы веществ при выведении коэффициентов в уравнении химической реакции.
3.Осуществлять рефлексию учебной деятельности

ТАБЛИЦА «ЗХУ»
Знаю
Хочу узнать
Узнал

ПРОБЛЕМА
Является ли закон сохранения массы веществ основой для составления уравнений химических реакций

ЧТО ОБОЗНАЧАЮТ ЦИФРЫ В ФОРМУЛЕ ВЕЩЕСТВА
Валентность
Коэффициент
2Н 2 О
Индекс
Закон сохранения массы веществ
Закон постоянства состава веществ

ВИДЕООПЫТ: ГОРЕНИЕ МАГНИЯ В КИСЛОРОДЕ

РЕШАЕМ ЗАДАЧУ!

ЗАПИШЕМ УРАВНЕНИЕ РЕАКЦИИ:
Mg + O 2 → MgO
исходные → продукты
вещества /
реагенты
Выпишем относительные атомные и молекулярные массы веществ:
24 + 2 . 16 = 40
Вещества ,
вступившие в реакцию
Вещества ,
образующиеся в результате реакции

УРАВНЕНИЕ РЕАКЦИИ:
1.Схема реакции:
Mg + O 2 → MgO
2 Mg + O 2 = 2 MgO
48+ 32 = 80
YES!
2.Составим уравнение, расставив
коэффициенты
3.Выпишем относительные
молекулярные массы веществ :

ОСНОВНЫЕ ПРАВИЛА РАССТАНОВКИ КОЭФФИЦИЕНТОВ
- Расстановку коэффициентов начинают с элемента, чьих атомов в реакции участвует больше.
- Количество атомов кислорода до и после реакции в большинстве случаев должно быть четным.
- Если в реакции (обмена) участвуют сложные вещества , то расстановку коэффициентов начинают с атомов металлов или с кислотных остатков.

??? Хим.явление
??? Хим.реакция
??? Хим.уравнение
Химическое уравнение
-это условная запись
химической реакции
с помощью химических
формул, знаков и коэффициентов
2 Mg + o 2 = 2 Mg o
H 2 + Cl 2 = 2HCl
2Al + 3O 2 = 2Al 2 O 3

ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ МОЖНО СУДИТЬ О ТОМ, КАКИЕ ВЕЩЕСТВА ВСТУПАЮТ В РЕАКЦИЮ И КАКИЕ ОБРАЗУЮТСЯ В РЕЗУЛЬТАТЕ НЕЕ
2 Mg + o 2 = 2 Mg o
Исходные в-ва Продукты
Реагенты реакции

ВИДЕО-ЗАДАЧА : НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ ГОРЕНИЯ ФОСФОРА ПО ВИДЕОФРАГМЕНТУ

- В левой части уравнения пишут формулы веществ, вступающих в реакцию, затем ставят стрелку
P + O 2 →
- В правой части пишут формулы веществ, образующихся в результате реакции
P + O 2 → P 2 O 5
Схема реакции

- На основе закона сохранения массы веществ составляют уравнение. Слева и справа должно быть одинаковое число атомов. Это достигается расстановкой коэффициентов перед формулами .
? P + ? O 2 → ? P 2 O 5
- Вначале уравнивают число атомов, которых в реагирующих веществах больше (это кислород)
- Находят НОК (для кислорода это 10)
- Делят НОК на число атомов в левой и правой части и находят коэффициенты
10 : 2 = 5 10 10 : 5 = 2
? P + 5 O 2 → 2 P 2 O 5

- Уравнивают число атомов остальных химических элементов (фосфора)
? P + 5 O 2 → 2 P 2 O 5 (слева 1, справа 4)
4 P + 5 O 2 → 2 P 2 O 5
Стрелку заменяют знаком =
4 P + 5 O 2 = 2 P 2 O 5
- Если реакция идет при нагревании то над = ставят t
- Если в результате реакции выделяется газ, то ставят
- Если в результате реакции выпадает осадок, то ставят

ВИДЕО-ЗАДАЧА : НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ ГОРЕНИЯ АЛЮМИНИЯ В КИСЛОРОДЕ ПО ВИДЕОФРАГМЕНТУ
t 0
4 Al + 3 О 2 = 2 Al 2O3

ВИДЕО-ЗАДАЧА : НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ ГОРЕНИЯ ЖЕЛЕЗА В КИСЛОРОДЕ ПО ВИДЕОФРАГМЕНТУ
t 0
4Fe + 3 О 2 = 2Fe 2 O 3
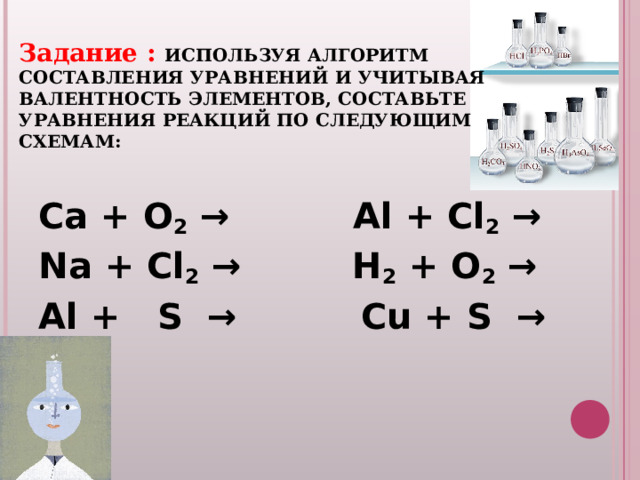
Задание : ИСПОЛЬЗУЯ АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ И УЧИТЫВАЯ ВАЛЕНТНОСТЬ ЭЛЕМЕНТОВ, СОСТАВЬТЕ УРАВНЕНИЯ РЕАКЦИЙ ПО СЛЕДУЮЩИМ СХЕМАМ:
Ca + O 2 → Al + Cl 2 →
Na + Cl 2 → H 2 + O 2 →
Al + S → Cu + S →
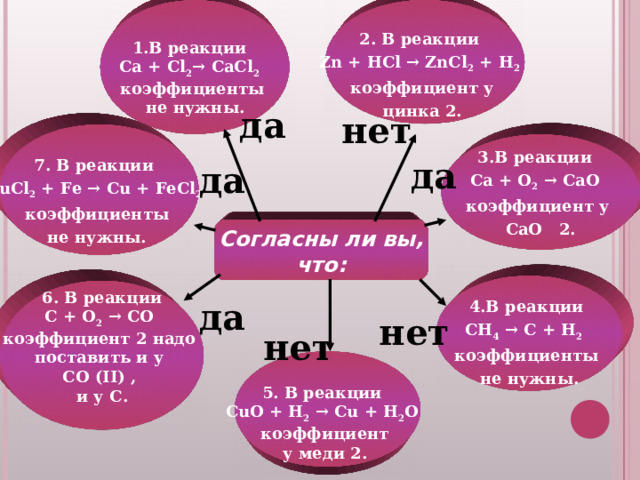
1.В реакции
Ca + Cl 2 → CaCl 2
коэффициенты
не нужны.
2. В реакции
Zn + HCl → ZnCl 2 + H 2
коэффициент у
цинка 2.
да
нет
7. В реакции
CuCl 2 + Fe → Cu + FeCl 2
коэффициенты
не нужны.
3.В реакции
Ca + O 2 → CaO
коэффициент у
CaO 2.
да
да
Согласны ли вы,
что:
4.В реакции
CH 4 → C + H 2
коэффициенты
не нужны.
6. В реакции
C + O 2 → CO
коэффициент 2 надо
поставить и у
CO ( II ) ,
и у C .
да
нет
нет
5. В реакции
CuO + H 2 → Cu + H 2 O
коэффициент
у меди 2.

ПРОБЛЕМА
Является ли закон сохранения массы веществ основой для составления уравнений химических реакций

МОЕ НАСТРОЕНИЕ

- Разобрать и выучить конспект.
- Повторить параграф: § 2.2
- Выучить параграф: § 2.3
- Выполнить задания:
упр.1,3,4 стр.28








































