
Галогены

План конспекта
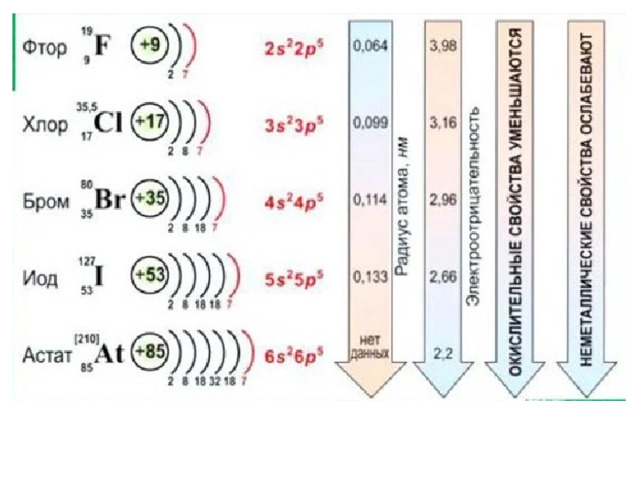
I. Общая характеристика
II. Нахождение в природе
III. Основные соединения
IV. Значение и применение
- Способы получения
- Химические свойства

I. Общая характеристика
- Галогены ( halogens – рождающие соли ) были открыты:
- Хлор – в 1774 г. Карлом Шееле;
- Иод – в 1811 г. Бернаром Куртуа;
- Бром – в 1826 г. Антуаном Баларом;
- Фтор – в 1886 г. Анри Муассаном.
- Образуют двухатомные молекулы состава Hal 2 . В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, имеют резкие запахи, летучи.
- Электронная конфигурация внешнего слоя электронной оболочки атомов галогенов в основном состоянии : ns 2 np 5
- Атом фтора возбужденного состояния не имеет.
- Степени окисления фтора: -1, 0
- Степени окисления хлора, брома и иода: -1, 0, +1, +3, +5, +7, также могут проявлять степень окисления +4, а хлор и бром и +6
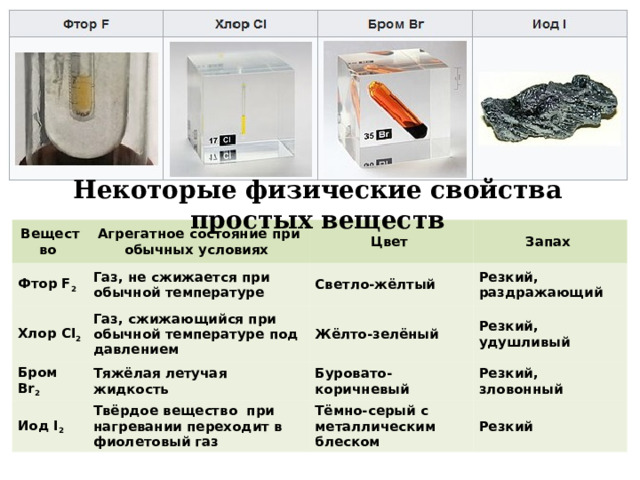
Некоторые физические свойства простых веществ
Вещество
Агрегатное состояние при обычных условиях
Фтор F 2
Хлор CI 2
Цвет
Газ, не сжижается при обычной температуре
Бром Br 2
Запах
Светло-жёлтый
Газ, сжижающийся при обычной температуре под давлением
Иод I 2
Жёлто-зелёный
Тяжёлая летучая жидкость
Резкий, раздражающий
Буровато-коричневый
Твёрдое вещество при нагревании переходит в фиолетовый газ
Резкий, удушливый
Резкий, зловонный
Тёмно-серый с металлическим блеском
Резкий

II. Нахождение в природе
- Галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде сложных веществ. Часто в виде солей: фторидов, хлоридов, бромидов, иодидов, получивших общее название – галогениды или галоиды.
- Многие галогениды растворимы в воде, в связи с чем основные их запасы сосредоточены в Мировом океане в виде анионов растворимых солей. Также могут эти элементы содержатся в морских живых организмах, в большей степени в водорослях.
- Наибольшее распространение имеют следующие минералы:
- CaF 2 – флюорит Na 3 AlF 6 - криолит
- 3Ca 3 (PO 4 ) 2 ×CaF 2 – фтораппатит NaCl - галит
- KCl – сильвин KCl • MgCl 2 • 6H 2 O - карналит
- NaCl • KCl - сильвинит

III. Основные соединения
- Летучие водородные соединения галогенов (галогеноводороды) – это газы без цвета, но с резким запахом, хорошо растворимые в воде. Растворы их являются кислотами:

III. Основные соединения
- У хлора, брома и иода также есть оксокислоты, образующие в реакциях кислородосодержащие соли:
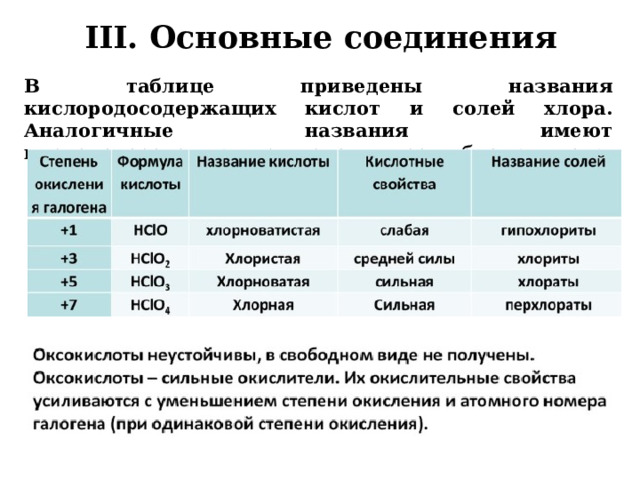
III. Основные соединения
В таблице приведены названия кислородосодержащих кислот и солей хлора. Аналогичные названия имеют кислородосодержащие кислоты и соли брома и иода.

IV. Значение и применение галогенов
Заполните в конспекте самостоятельно

Способы получения галогенов
Фтор , как и щелочные металлы, получают с помощью электролиза расплавов солей :
2KF → 2K + F 2 ↑
расплав
В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl→ 2Na + Cl 2 ↑
расплав
2NaCl + 2H 2 O → H 2 ↑ + 2NaOH + Cl 2 ↑
раствор
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями:
MnO 2 + 4HCl → MnCl 2 + Cl 2 ↑ + 2H 2 O

Химические свойства галогенов
Реагируют с металлами , как окислители, образуя галогениды (иод обладает меньшими окислительными свойствами):
3Cl 2 + 2Fe → 2FeCl 3 , но I 2 + Fe → FeI 2
Cl 2 + Cu → 2CuCl 2 , но I 2 + 2Cu → 2CuI
Хлор, бром и иод реагируют с большинством неметаллов (кроме O 2 ), образуя бинарные соединения:
2P + 3Cl 2 → 2PCl 3
5Cl 2 + 2P 2PCl 5
Фтор реагирует со всеми неметаллами , включая и кислород , образуя его фториды:
2F 2 + O 2 → 2OF 2

Химические свойства галогенов
Во фторе вода горит со взрывом:
2F 2 + 2H 2 O → 4HF + O 2
Остальные галогены охотно диспропорционируют при растворении в воде или в щелочах :
Cl 2 + H 2 O ↔ HCl + HClO
Сl 2 + 2NaOH (хол.) → NaCl + NaClO + H 2 O
3Cl 2 + 6NaOH (гор.) → 5NaCl + NaClO 3 + 3H 2 O
При взаимодействии хлора без нагревания с гашеной известью образуется смесь хлорида и гипохлорита кальция, известная, как «хлорка» ( смешанная соль может быть записана как CaOCl 2 ):
2Сl 2 + 2Са(OH) 2(хол.) → СaCl 2 + Сa(ClO) 2 + 2H 2 O

Химические свойства галогенов
С оксидами и кислотами такие галогены, как хлор, бром и иод не взаимодействуют
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов. Также все они могут вытеснять серу из сульфидов и сероводорода :
Так, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl 2 + 2NaI → 2NaCl + I 2
Cl 2 + 2NaBr → 2NaCl + Br 2
А иод может вытеснить серу:
I 2 + H 2 S → 2HI + S
I 2 + K 2 S → 2KI + S































