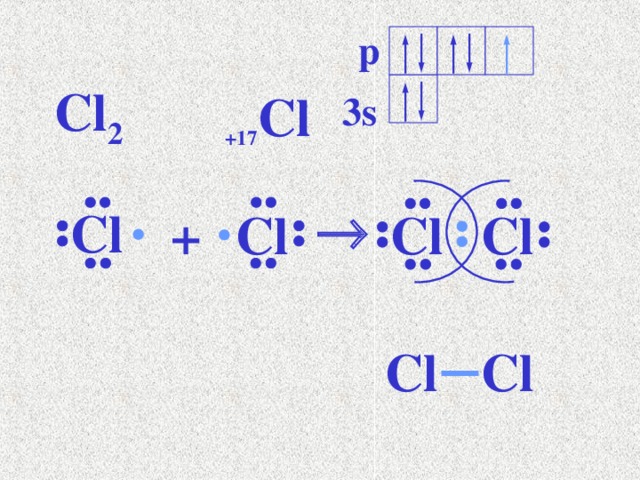Химиялық байланыстың (типтері), валенттілік,
тотығу дәрежесі

ДЕМОКРИТ
(б.э.д. 460 – 370 ж.ж. )
Әлемде тек қана атомдар, бос кеңістік және қозғалыс бар, деп оқытты.
Древнегреческий философ Демокрит считается основоположником материалистического взгляда на атомистическое строение материи.
Демокрит учил, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов, которые непрерывно движутся в пустоте. Их никто не создавал, никто не может уничтожить, хотя разрушить тела, составленные из атомов – труд небольшой.
Демокрит не верил в богов, не допускал случайностей, поэтому для объяснения столкновения атомов в пустоте придумал какую-то механическую необходимость или «рок» . А чтобы было понятно, как атомы держатся друг за друга, он снабдил их петельками и крючочками.
Щ
Ол атомдардың бос кеңістікте соқтығысуының механикалық қажеттілігін ойлап тапты.
Түсінікті болуы үшін, атомдарды бір-бірімен бекіту үшін ілгешекпен, ілгекті пайдаланды.

ПЛАТОН
(б.э.д. 427 – 347 ж.ж. )
Атомдар – бұл екі түрлі тік бұрышты үшбұрыштар: катеті тең бүйірлі және гипотенузаның жартысына тең.
Платон өзінің шәкірттеріне өте көрнекі түрде үшбұрыштың бөлшектері арқылы орындалатын барлық өзгерістерді көрсетті.
Античный философ Платон представлял атомы как плоские тела - прямоугольные треугольники двух видов: равнобедренные и с катетом, равным половине гипотенузы.
Они удобны для конструирования более сложных фигур. Четыре равнобедренных треугольника составляют квадрат, а из шести прямоугольных треугольников образуется равносторонний треугольник.
Щ
ЙЁНС-ЯКОБ БЕРЦЕЛИУС
(1779 – 1848 ж.ж.)
Электрохимиялық теория
Химиялық элементтер арасындағы байланысты олардың электрлік қасиеті тұрғысынан қарастырды. Яғни, химиялық элементтердің бір түрінде оң, ал екіншілерінде теріс заряд басым болады. Оң заряды басым элементтерге металдарды, ал теріс заряды бар элементтерге металл еместерді жатқыза отырып, химиялық қосылыстар осылардың арасындағы тартылыстан туындайды деп есептелінді .
Взгляды Демокрита и Платона господствовали довольно долго.
В начале 19 века шведский химик Йёнс-Якоб Берцелиус предложил электрохимическую теорию сродства. Он считал, что атомы притягиваются друг к другу благодаря наличию у каждого из них двух противоположных электрических зарядов, находящихся на некотором расстоянии друг от друга. Идея о том, что силы, удерживающие атомы в молекуле, имеют электрическую природе, оказалась верной.
ЭКСПЕРИМЕНТ – получение водорода:
Пропустите одну строчку тетради???
на доске записать уравнение реакции в молекулярном виде и с помощью графических формул.
Состав веществ определяли экспериментально.
Рассмотрим схему взаимодействия цинка с соляной кислотой.
Щ

Аталған ілім біртүрлі атомдардан тұратын оттегі, сутегі, азот сияқты жай заттар арасындағы байланысты түсіндіре алмады.
H-H H 2
O=O O 2
N≡N
N 2

ХИМИЯЛЫҚ БАЙЛАНЫС
- химиялық қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күштер жиынтығы
Сегодня на уроке мы начинаем изучать новую тему: ХИМИЧЕСКАЯ СВЯЗЬ. Запишите тему урока. Что же мы понимаем под «химической связью»?
Щ. Химическая связь – это совокупность сил, обусловливающих взаимодействие атомов друг с другом в химическом соединении. Запишите.
Щ.
5

Иондық химиялық байланыс электртерістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі.
Иондық химиялық байланыс қарама –қарсы зарядталған иондардың электростатикалық тартылысы нәтижесінде жүзеге асады.

Иондық байланыс теориясын 1916 жылы неміс ғалымы
В. Коссель ұсынған болатын. Бұл теория типтік металдар мен типтік бейметалдар атомдары арасында: CsF, CsCl, NaCl, KF, KCl, Na 2 O, CaO түзілетін байланысты түсіндіреді. Осы теорияға байланысты иондық байланыстың түзілу кезінде типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды қосып алады.
КОССЕЛЬ ( Kossel),
Вальтер
1888 – 1956 ж.ж.

Металдар химиялық әрекеттесуде валенттік
электрондарын беріп, оң зарядты иондарға (катиондарға):
Na 0 – e = Na +
Бейметалдар электрондар қосып алып, теріс зарядты
иондарға (аниондарға) айналады:
Cl 0 + e = Cl - . Әр аттас зарядты иондар бірін-бірі
тартып молекула құрайды:

Иондық қосылыстар молекуласындағы барлық иондар зарядтарының алгебралық қосындысы нөлге тең болу қажет. Осыған байланысты кез келген молекула электр бейтарап бөлшек болып табылады.

Ковалентті байланыс – бұл атомдар арасында ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыс.
Ковалентті химиялық байланыста электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.

Ковалентті байланыс теориясын
1916 жылы американдық ғалым Джильбер Льюис ұсынды. Осы теорияға сай, ковалентті байланыс түзілуінің негізгі себебі атомдар арасында ортақ электрондық жұптың түзілуі болып табылады. Ковалентті байланыс жай зат молекулалары арасында ( H 2 ) , Cl 2 , O 2 , N 2 және әр түрлі бейметалдар атомдары арасында (HCl, H 2 O, PCl 3 , NH 3 CO 2 түзіледі .
Джильбер Льюис

Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасады. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.
Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс . Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюсті молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
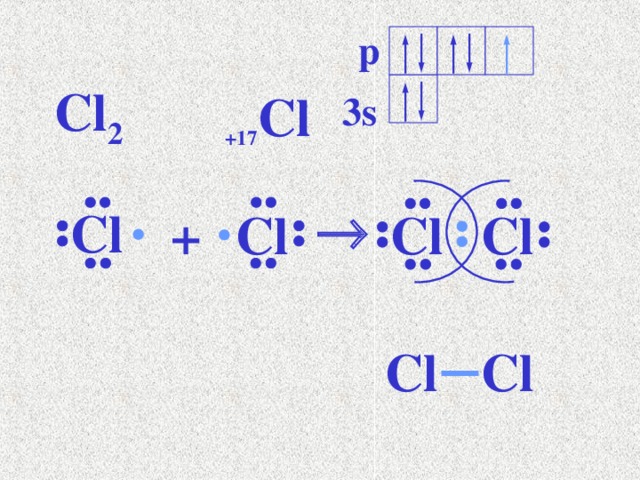
p
Cl 2
+17 Cl
3s
Cl
Cl
Cl
Cl
+
Cl
Cl

Электрондардың электрон бұлттарының формаларын
қолданып байланыстың түзілуін көрсетсек:

Вещества с КНС имеют:
Ковалентті полюссіз байланысқан заттар
Молекулалық кристалл торлы заттар
Молекулярную кристаллическую
решетку ( все остальные)
Атомдық кристалл торлы заттар (С , Si, B)
Атомную кристаллическую
решетку ( C, Si, B)
Заттардың қасиеттері:
- Қалыпты жағдайда газ тәрізді заттар ( H 2 , O 2 ) , сұйық ( Br 2 ), қатты ( I 2 );
- Заттардың көпшілігі ұшқыш заттар, балқу және қайнау температурасы төмен;
- Ерітінділері мен балқымалары электр тогын өткізбейді.
Заттардың қасиеттері
1.Қатты
2.Қайнау және балқу температурасы жоғары
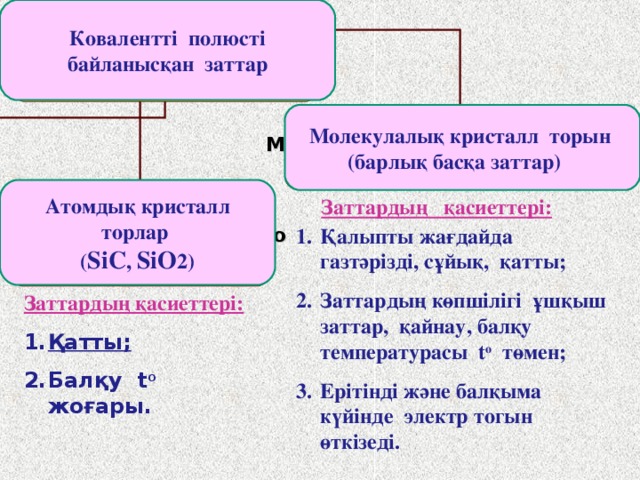
Ковалентті полюсті байланысқан заттар
Вещества с КПС имеют:
Молекулалық кристалл торын (барлық басқа заттар)
Молекулярную кристаллическую
решетку (все остальные)
- Қалыпты жағдайда газтәрізді, сұйық, қатты;
- Заттардың көпшілігі ұшқыш заттар, қайнау, балқу температурасы t o төмен;
- Ерітінді және балқыма күйінде электр тогын өткізеді.
Атомдық кристалл торлар
( SiC , SiO 2)
Заттардың қасиеттері:
Атомную крисаллическую
Решетку ( SiC, SiO 2 )
Заттардың қасиеттері:

Металдық кристалл торының түйіндерінде атомдар немесе
олардың иондары орналасатыны белгілі.
Металдық тордағы бостау күйдегі делокальданған
электрондар көптеген ядролардың арасында өзара тарту
күштерін тудырып, металдық байланыс түзеді.
Металдық байланыстың түзілу схемасы (М – металл): Me – ne - → Me +n
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр және жылу өткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т.б. бұлардың барлығы да металдық байланысқа тәуелді.
_

Химиялық байланыстың негізгі сипаттамалары:
- байланыс энергиясы
- байланыс ұзындығы
- валенттік бұрыш
Байланыс энергиясы – өзара байланысқан атомдарды не иондарды бір – бірінен ажырату үшін жұмсалатын энергия.
Байланыс ұзындығы – химиялық байланыстағы
атомдар ядроларының арасындағы қашықтық, валенттік бұрыш – байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш.
Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.

Тотығу дәрежесі
Тотығу дәрежесі, тотығу саны – химиялық
қосылысты тек иондардан тұрады деп
қарастырғанда әр атомда болатын шартты
зарядтың сан шамасы. Бұл ұғым молекуладағы
атомдардың күйін сипаттау үшін қолданылады.
Кез келген қосылысты ионды қосылыс деп
қарастыруға болмайтындықтан, тотығу дәрежесі
шартты түрде алынады.
- Барлық күрделі қосылыстағы металдар тек қана оң тотығу дәрежесін көрсетеді.
- Бейметалдар оң және теріс тотығу дәрежесін көрсете алады. Бейметалдар сутекпен және металдармен қосылыстарында үнемі теріс мәнге ие.
- Элементтің ең жоғарғы (максимальді) тотығу дәрежесі периодтық кестедегі топтың нөміріне байланысты болады.
- Металдардың ең кіші тотығу дәрежесі нөлге тең болады.
- Ең жоғарғы тотығу дәрежесі мен ең төмен тотығу дәрежесіндегі аралықты аралық тотығу дәрежесі деп атайды.

тұрақты
H,K,Zn
ауыспалы
Cl,P,Se
Тотығу дәрежесі
оң
Na,Al,Ca
теріс
S -2 ,N -3 ,O -2
жай заттардың т.д.
Fe 0 ,Cl 2 0 ,H 2 0