Просмотр содержимого документа
«Кислород, его получение и физические свойства.»

Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства

План лекции:
- 1 . Кислород – химический элемент:
- а) Характеристика химического элемента – кислорода по его положению в ПСХЭ
- б) Валентные возможности атома кислорода
- в) Распространённость химического элемента в природе
- 2. Кислород – простое вещество
- а) Получение кислорода
- б) Химические свойства кислорода
- в) Круговорот кислорода в природе
- г) Применение кислорода

- « Кислород – это вещество, вокруг которого вращается земная химия»
Яков Берцелиус

1. Кислород – химический элемент
- а) Характеристика химического элемента – кислорода по его положению в ПСХЭ:
- Порядковый номер –
- Номер Периода –
- Группа (подгруппа) –
- Относительная атомная масса Ar –
- Произношение –

1. Кислород – химический элемент
- б) Валентные возможности атома кислорода
│
VI – не существует
│
│
│ О 2 ↑, ц , з , Mr(O 2 )=32
│ кислород
Кислород
│ О 3 ↑, ц , з, Mr(O 3 )=48
│ озон
│
II - оксиды; OF 2 - фторид кислорода.
│
Внимание! H 2 O 2 (перекись водорода) – O (II)
СО (угарный газ) – О (III)

1. Кислород – химический элемент
- в) Распространённость химического элемента кислорода в природе
- Кислород — самый распространенный на Земле элемент

2. Кислород – простое вещество
- а) Получение кислорода
- Впервые кислород получил
- Джозеф Пристли (англ.)
- 1 августа 1774 г
- 2HgO t˚C 2Hg + O 2 ↑
- он назвал газ – «воздух»

- Главная роль
- Антуан Лоран Лавуазье

б) Получение кислорода
- Получение в лаборатории
- 1) Разложение перманганата калия (марганцовка):
- 2KMnO 4 t˚C K 2 MnO 4 +MnO 2 +O 2 ↑
- 2) Разложение перекиси водорода:
- 2H 2 O 2 MnO2 2H 2 O + O 2 ↑
- 3) Разложение бертолетовой соли:
- 2KClO 3 t˚C , MnO2 2KCl + 3O 2 ↑

б) Получение кислорода
- Получение в промышленности
- 1) Электролиз воды
- 2H 2 O эл. ток 2H 2 + O 2 ↑
- 2) Из воздуха
- ВОЗДУХ давление, t=-183˚C O 2 (голубая жидкость)
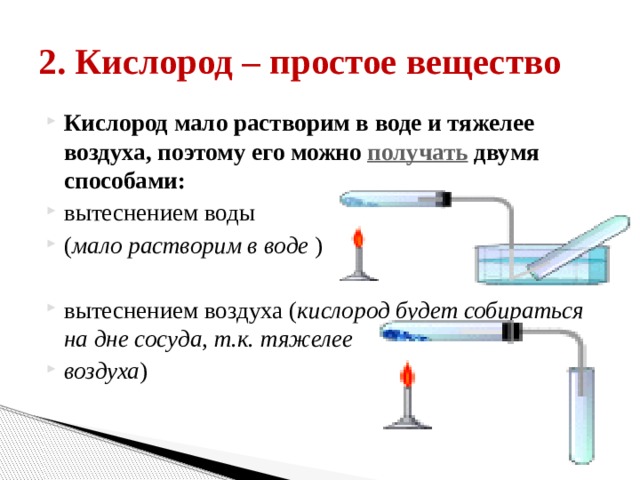
2. Кислород – простое вещество
- Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
- вытеснением воды
- ( мало растворим в воде )
- вытеснением воздуха ( кислород будет собираться на дне сосуда, т.к. тяжелее
- воздуха )

2. Кислород – простое вещество
- б) Химические свойства кислорода

Алгоритм составления уравнений реакций окисления на примере алюминия и метана

2. Кислород – простое вещество
- Закончить УХР горения и назвать продукты реакции:
- K + O 2 =
- S + O 2 =
Внимание! Сера в реакциях горения S(IV)
- P + O 2 =
- N 2 + O 2 =
- C 2 H 6 + O 2 =
- H 2 S + O 2 =
- PH 3 + O 2 =
- ZnS + O 2 =
- Fe + O 2 = Внимание!

2. Кислород – простое вещество
- Почему кислорода на планете не становится меньше?

2. Кислород – простое вещество

« Он всюду и везде:
В камне, в воздухе, в воде,
Он и в утренней росе
И небес голубизне…»








































