Кислоты и их свойства
Кислоты - это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: Hx(Ac)n, где Ac - кислотный остаток (acid - англ. кислота), х - число атомов водорода, n - степень окисления кислотного остатка. В кислотах x=n.
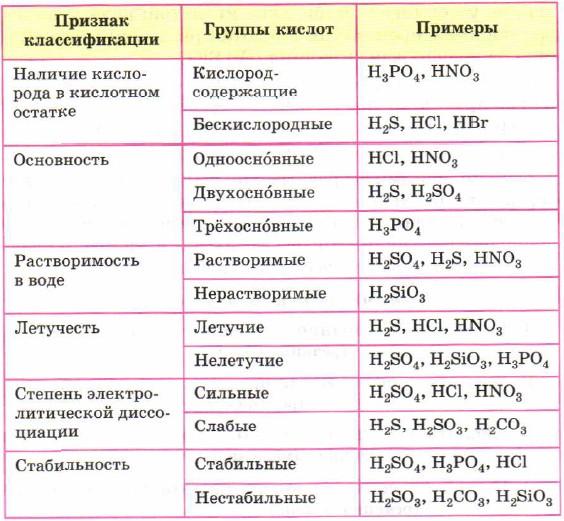
Классификация кислот
проводится по следующим формальным признакам:
Номенклатура кислот
Названия бескислородных кислот образуются от названия элемента с суффиксом -о и прибавлением слов «водородная кислота»: HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная.
Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс(ная, овая, истая и пр.) кислота.
Суффикс -ная, -вая характерен для кислот, содержащих элемент в высшей степени окисления. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, H2S+6O4 — серная кислота, но H2S+4O3 сернистая кислота
HCl+7O4 — хлорная кислота,
HCl+5O3 — хлорноватая кислота,
HCl+3O2 — хлористая кислота,
HCl+1O - хлорноватистая кислота.
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-. Например, HPO3 метафосфорная кислота и H3PO4 ортофосфорная кислота.
Для многих неорганических кислот характерны тривиальные названия:
плавиковая кислота - HF или фтороводородная
синимальная кислота - HCN или циановодородная
соляная кислота - HCl или хлороводородная
| Название кислоты | Формула кислоты |
| Плавиковая (фтороводородная) | HF |
| Соляная (хлороводородная) | HCl |
| Бромоводороная | HBr |
| Йодоводородная | HI |
| Серная | H2SO4 |
| Сернистая | H2SO3 |
| Сероводородная | H2S |
| Азотная | HNO3 |
| Азотистая | HNO2 |
| Фосфорная (ортофосфорная) | H3PO4 |
| Угольная | H2CO3 |
| Кремниевая | H2SiO3 |
| Марганцевая | HMnO4 |
| Двухромовая | H2Cr2O7 |
| Синильная (циановодородная) | HCN |
Химические свойства кислот
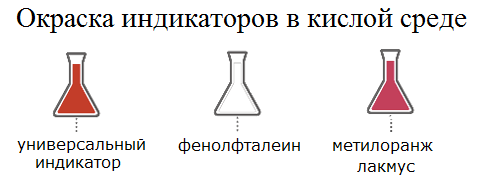
1) Кислоты изменяют окраску индикаторов, поскольку в растворах кислот присутствует H+:
2) Кислоты реагируют с металлами, стоящими в ряду напряжений левее водорода
Mg+H2SO4=MgSO4+H2
Металлы, стоящие в электрохимическом ряду напряжения после водорода не вытесняют его из кислот.

Сильные кислоты-окислители (HNO3,H2SO4) взаимодействуют с металлами по-разному в зависимости от концентрации кислоты и активности металла, см. темы "Взаимодействие серной кислоты с металлами и неметаллами", "Взаимодействие азотной кислоты с металлами".
3) Кислоты реагируют с основаниями с образованием соли и воды (реакция нейтрализации):
3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2O
4) Кислоты реагируют с основными оксидами с образованием соли и воды:
CaO+2HCl=CaCl2+H2O
5) Кислоты реагируют с солями (реакция обмена), в случае если выполняются следующие условия:
кислота, вступающая в реакцию, сильнее кислоты, образующей соль (то есть более сильная кислота вытесняет более слабую кислоту);
в результате реакции один из продуктов "уходит" из сферы реакции в виде осадка, газа или слабого электролита (правило Бертолле)
H2SO4+BaCl2=BaSO4↓+2HCl
CaCO3+2HCl=CaCl2+CO2↑+H2O




















