| 1. Соли реагируют с кислотами А ) новая соль выпадает в осадок CuSO4 + H2S = CuS ↓+ H2SO4 AgNO3 + HCl = AgCl↓ + HNO3 СaCl2 + H2SO4 CaSO4 + 2HCl ВaCl2 + H2SO4 ВaSO4 + 2HCl Образование кислой соли Na2SO4 + H2SO4 2NaHSO4 Б) образуется газообразное вещество 2HCl + Na2CO3 2NaCl + CO2↑ + H2O 2HCl + Na2S 2NaCl + Н2S↑ 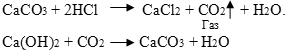 В) образуется кислота в осадке Na2Si O3 + 2HCl → H2Si O3↓ +NaCl 2 Соли при нагревании разлагаются 2КNO3  2КNO2 + O2. 2КNO2 + O2. 3. Взаимодействие с кислотными оксидами. СО2 + Na2SiO3 Na2CO3 + SiO2 Na2CO3 + SiO2 СО2 + Na2SiO3 СО2 + Na2SiO3
| 4. Соли реагируют с солями если новая соль выпадает в осадок BaCl2 + K2SO4 = BaSO4 + 2 KCl CaCl2 + Na2CO3 = CaCO3 + 2NaCl AgNO3 + KCl AgCl + KNO3 5. Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au Fe + CuSO4 Cu + FeSO4 Cu + 2AgNO = Cu(NO = Cu(NO ) ) + 2Ag + 2Ag 6. соли реагируют с основаниями А.) новое основание выпадает в осадок FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl CuSO4 + 2 KOH = Cu(OH)2 ↓+ K2SO4 ZnSО4 + 2NaOH Na2SO4 + Zn(OH)2. СuСl2 + 2NaOН = Сu(ОН)2 + 2NaCl + 2NaCl Б) новая соль выпадает в осадок Ca(OH)2 + К2SO4 CaSO4 + 2KOH Вa(OH)2 + Na2SO4 ВaSO4 + 2NaOH Ba(OH)2 + Na2CO3 2NaOH + BaCO3
|




























