8 класс ХИМИЯ Дата проведения___________________ Урок 2. ТЕМА: Оксиды
Цель: Повторить и закрепить знания об оксидах
Задачи:
- актуализировать знания учащихся о классификации неорганических веществ;
- систематизировать информацию о составе и свойствах оксидов,
- развивать умения сравнивать и обобщать, составлять формулы сложных веществ, давать названия веществам;
- продолжать формирование понятия о связи оксидов с другими неорганическими соединениями, представлений об их использовании в повседневной жизни человека;
-прививать навыки самостоятельной работы, учить четко и грамотно выражать свои мысли.
Оборудование и реактивы: образцы или фотографии изделий и материалов на основе оксидов (стекло, песок, минеральные краски др.), рабочая тетрадь.
Основные требования к результатам учебной деятельности учащихся
Учащиеся должны знать:
понятия: простое и сложное вещество, классы неорганических соединений (оксиды, кислоты, основания, соли),
Учащиеся должны уметь:
определять: принадлежность вещества к оксидам по химической формуле;
различать: оксиды по формулам;
составлять: формулу оксида по названию вещества.
Методические рекомендации по проведению учебного занятия
Тип урока: повторение
Ход урока
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
– Здравствуйте. Присаживайтесь. Дежурные, назовите отсутствующих
ЦЕЛЕПОЛАГАНИЕ И МОТИВАЦИЯ
Основные вопросы обучающей части урока:
- классификация оксидов на кислотные и основные;
-химические свойства оксидов,
-получение оксидов;
- применение оксидов.
СИСТЕМАТИЗАЦИЯ ЗНАНИЙ
Систематизацию знаний о классификации и свойствах оксидов лучше всего провести, анализируя вместе со школьниками информацию, приведенную в табл. 2 учебника. При этом необходимо обратить внимание на химические свойства кислотных оксидов ( реагируют с водой, образуя кислоты; реагируют со щелочами, образуя соль и воду; реагируют с основными оксидами, образуя соль и воду) и основных оксидов (реагируют с водой, образуя щёлочи; реагируют с кислотами, образуя соль и воду), иллюстрируя каждое положение записью уравнений реакций.
Работа может осуществляться фронтально с записью результатов на доске или в парах с последующей самопроверкой.
Оксиды - это соединения, состоящие из двух элементов, одним из которых является кислород .
Классификация оксидов.
Оксиды делятся на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп.

ОКСИДЫ

СОЛЕОБРАЗУЮЩИЕ
НЕСОЛЕОБРАЗУЮЩИЕ (безразлич-ные, индеферентные)
СО, SiO2, N2O, NO


КИСЛОТНЫЕ
СО2, N2O5, SO3
ОСНОВНЫЕ
K2O, CaO, CuO.
АМФОТЕРНЫЕ
Al2O3, ZnO, BeO
Несолеобразующие оксиды - это оксиды, которые не взаимодействуют ни с кислотами , ни со щелочами и не образуют солей.
Солеобразующие оксиды - это оксиды, которые взаимодействуют с кислотами или щелочами с образованием солей и воды. Солеобразующие оксиды делятся на основные, кислотные, амфотерные.
По агрегатному состоянию оксиды делятся на твердые (CaO, MgO, SiO2, P2O5), жидкие (SO3, H2O, Cl2O7) и газообразные ( CO2, N2O, NO, SO2).
По растворимости в воде оксиды делятся на растворимые (основные оксиды щелочных и щелочноземельных металлов, практически все кислотные оксиды(кроме SiO2)) и нерастворимые ( все остальные основные оксиды, амфотерные оксиды, SiO2).
Химические свойства оксидов.
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые можно выразить следующей схемой:
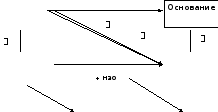
+ Н2О
Соль
Кислота
Кислотный оксид
Основный оксид
Основные оксиды образуют только металлы и, как правило, в степени окисления +1 и +2 (исключение: BeO, ZnO, SnO, PbO).
Основные оксиды взаимодействуют:
1) с кислотами по схеме: Основный оксид + Кислота = Соль + Вода
MgO + 2HCl = MgCl2 + H2O
2) с кислотными оксидами по схеме:
Основный оксид + Кислотный оксид = Соль
3K2O + P2O5 = 2K3PO4
3) c водой взаимодействуют только оксиды щелочных и щелочно-земельных металлов по следующей схеме: Основный оксид + Вода= Щелочь
CaO + H2O = Ca(OH)2
Кислотные оксиды – это оксиды, которым в качестве гидроксидов, соответствуют кислоты.
Кислотные оксиды образуют все неметаллы независимо от степени окисления (исключение – несолеобразующие оксиды) и металлы в степни окисления + 5 и выше.
Кислотные оксиды взаимодействуют:
с основаниями, образуя соль и воду : Кислотный оксид + Основание = Соль + Вода
N2O5 + 2NaOH = 2NaNO3 + H2O
с основными оксидами, образуя соль:
Кислотный оксид + Основный оксид = Соль
CO2 + MgO = MgCO3
водой кислотные оксиды взаимодействуют с образованием кислот (исключение SiO2):
Кислотный оксид + Вода = Кислота
Р2О5 + 3Н2О = 2Н3РО4
Оксиды могут быть получены различными способами.
Взаимодействие простых веществ – металлов и неметаллов – с кислородом:
2Cu + O2 = 2CuO 4P + 5O2 = 2P2O5
Горением на воздухе сложных веществ ( при этом, как правило, образуются оксиды тех элементов, из которых состоит это сложное вещество).
СН4 +2О2= СО2 + 2Н2О
3) Разложением сложных веществ, например нерастворимых оснований:
Сu(OH)2 → CuO + H2O
некоторых кислот: H2SiO3 → SiO2 + H2O
некоторых солей: CaCO3 → CO2 + CaO
ДИНАМИЧЕСКАЯ ПАУЗА
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ.
Для закрепления знаний можно предложить дополнительное задание (по вариантам):
С какими из перечисленных веществ - оксид серы(VI), гидроксид калия, серная кислота, вода – будет вступать в реакцию оксид кальция? Составьте соответствующие уравнения реакций, укажите их тип.
С какими из перечисленных веществ – вода, оксид кальция, гидроксид калия, соляная кислота – будет вступать в реакцию оксид углерода (IV)? Составьте соответствующие уравнения реакций, укажите их тип.
Кислотными оксидами являются все вещества в ряду:
1) MnO, FeO, CuO, Mn2O7 , CrO3, SO3, NO2, N2O, NO, Al2O3, MgO, CO, Al2O3, MgO, CO.
Для закрепления изученного материала предлагаем расчетную задачу:
Определите массу (г) карбоната натрия, который можно получить при взаимодействии углекислого газа объёмом 6,72 дм3 (н.у.) с раствором гидроксида натрия?
Во время РЕФЛЕКСИВНО-ДИАГНОСТИЧЕСКОГО ЭТАПА учитель получает информацию о проблемных зонах для последующей коррекции знаний и умений учащихся.
ДОМАШНЕЕ ЗАДАНИЕ: Учащимся сообщается тема следующего урока и дается домашнее задание.
§ 3, задания 4, 5, 6.























Химия 10 класс ФГОС
Химия 9 класс ФГОС
Электронная тетрадь по химии 10 класс...
Химия 8 класс
Химия. Вводный курс. 7 класс ФГОС
Электронная тетрадь по химии 11 класс...
Электронная тетрадь по химии 7 класс...
Химия 11 класс ФГОС
© 2018, Нестерова Юлия Владимировна 1832 95
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы