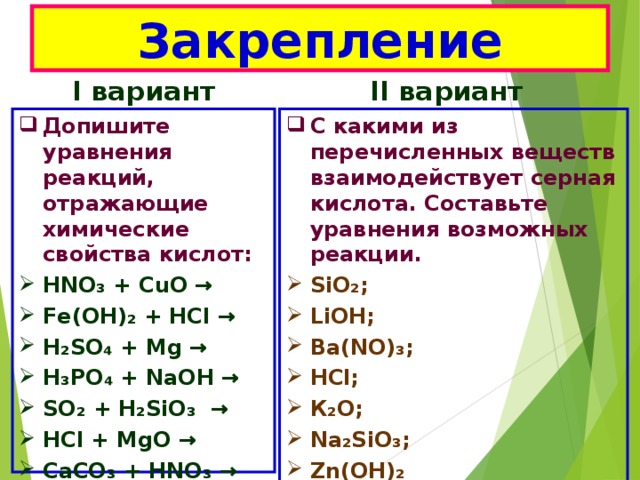
Свойства кислот № 2.
Теоретическая часть:
Химическими свойствами веществ называют такие свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, т.е. проявляемые в процессе химической реакции и влияющие на неё.
Признаки химических реакций — выделение газа, выпадение осадки, изименение цвета раствора.
Типичные реакции кислот:
Кислота + основание → соль + вода. (реакция обмена, реакция нейтрализации)
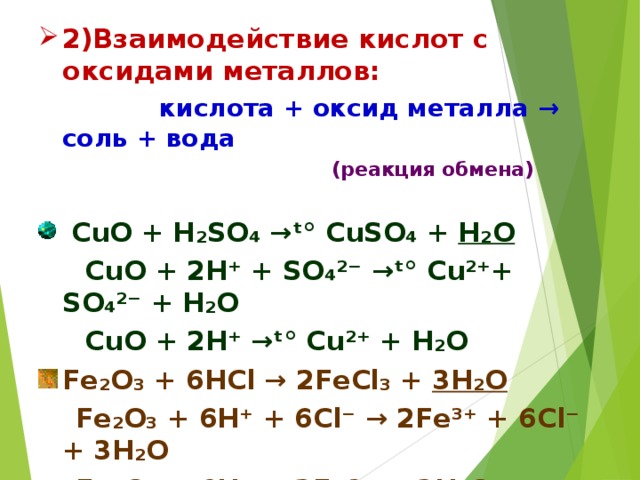
Кислота + оксид металла → соль + вода. (реакция обмена)
Кислота + металл → соль + водород. (реакция замещения)
Кислота + соль → новая кислота + новая соль. (реакция обмена)
Практическая часть:
«Взаимодействие кислоты с оксидом».
Оборудование и реактивы: штатив для пробирок, пробирка, спиртовка, спички, пробиркодержатель; оксид меди (II), раствор азотной кислоты.
Правила техники безопасности:
Запрещается брать вещества руками.
Запрещается оставлять открытыми склянки с реактивами.
Едкое вещество — кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора кислоты немедленно смойте струёй холодной воды, а затем обработайте повреждённую поверхность 2%-м раствором питьевой соды.
Пробирку закрепляйте в пробиркодержателе у отверстия.
Зажигайте спиртовку спичкой. Гасите спиртовку, накрывая пламя колпачком.
Нагревайте вещества в верхней части пламени, так как она самая горячая.
Содержание и порядок выполнения работы:
В пробирку поместите намного (объёмом со спичечную головку) порошка оксида меди (II). Отметьте цвет вещества.
Налейте в пробирку с оксидом меди (II) 1-2 мл раствора азотной кислоты. Для ускорения реакции слегка нагрейте (не доводя до кипения) содержимое пробирки. Что наблюдаете?
Напишите молекулярное и ионные уравнения реакций оксида меди (II) с азотной кислотой.
Подготовтесь к выступлению.
Свойства кислот № 1.
Теоретическая часть:
Химическими свойствами веществ называют такие свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, т.е. проявляемые в процессе химической реакции и влияющие на неё.
Признаки химических реакций — выделение газа, выпадение осадки, изименение цвета раствора.
Типичные реакции кислот:
Кислота + основание → соль + вода. (реакция обмена, реакция нейтрализации)
Кислота + оксид металла → соль + вода. (реакция обмена)
Кислота + металл → соль + водород. (реакция замещения)
Кислота + соль → новая кислота + новая соль. (реакция обмена)
Практическая часть:
«Взаимодействие кислоты с основанием».
Оборудование и реактивы: штатив для пробирок, пробирка; раствор гидроксида натрия, раствор серной кислоты, фенолфталеин.
Правила техники безопасности:
Запрещается брать вещества руками.
Запрещается оставлять открытыми склянки с реактивами.
Едкое вещество — кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора кислоты немедленно смойте струёй холодной воды, а затем обработайте повреждённую поверхность 2%-м раствором питьевой соды.
Едкое вещество — щёлочь! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора щёлочи немедленно смойте струёй холодной воды, а затем обработайте повреждённую поверхность 2%-м раствором уксусной кислоты.
Содержание и порядок выполнения работы:
Налейте в пробирку 2 мл раствора гидроксида натрия и добавьте к нему 1-2 капли фенолфталеина. Что наблюдаете? Объясните, какие частицы в растворе гидроксида натрия вызвали изменение окраски индикатора.
К раствору щёлочи с фенолфталеином добавляйте по каплям серную кислоту, перемешивая содержимое пробирки. Что вы наблюдаете? Объясните, образование какого вещества привело к изменению окраски индикатора.
Напишите молекулярное и ионные уравнения проведённой реакции.
Подготовтесь к выступлению.
Свойства кислот № 4.
Теоретическая часть:
Химическими свойствами веществ называют такие свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, т.е. проявляемые в процессе химической реакции и влияющие на неё.
Признаки химических реакций — выделение газа, выпадение осадки, изименение цвета раствора, нагревание или охолождение пробирки с реактивами.
Типичные реакции кислот:
Кислота + основание → соль + вода. (реакция обмена, реакция нейтрализации)
Кислота + оксид металла → соль + вода. (реакция обмена)
Кислота + металл → соль + водород. (реакция замещения)
Кислота + соль → новая кислота + новая соль. (реакция обмена)
Практическая часть:
«Взаимодействие кислоты с солью».
Оборудование и реактивы: штатив для пробирок, пробирка; раствор карбоната натрия, раствор соляной кислоты.
Правила техники безопасности:
Запрещается брать вещества руками.
Запрещается оставлять открытыми склянки с реактивами.
Едкое вещество — кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора кислоты немедленно смойте струёй холодной воды, а затем обработайте повреждённую поверхность 2%-м раствором питьевой соды.
Содержание и порядок выполнения работы:
Налейте в пробирку 1-2 мл раствора карбоната натрия и добавьте к нему 1-2 мл соляной кислоты. Что наблюдаете?
Напишите молекулярное и ионные уравнения проведённой реакции.
Подготовтесь к выступлению.
Свойства кислот № 3.
Теоретическая часть:
Химическими свойствами веществ называют такие свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, т.е. проявляемые в процессе химической реакции и влияющие на неё.
Признаки химических реакций — выделение газа, выпадение осадки, изименение цвета раствора.
Типичные реакции кислот:
Кислота + основание → соль + вода. (реакция обмена, реакция нейтрализации)
Кислота + оксид металла → соль + вода. (реакция обмена)
Кислота + металл → соль + водород. (реакция замещения)
Кислота + соль → новая кислота + новая соль. (реакция обмена)
Практическая часть:
«Взаимодействие кислоты с металлами».
Оборудование и реактивы: штатив для пробирок, пробирка; медь, цинк, раствор соляной кислоты.
Правила техники безопасности:
Запрещается брать вещества руками.
Запрещается оставлять открытыми склянки с реактивами
Едкое вещество — кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу капли раствора кислоты немедленно смойте струёй холодной воды, а затем обработайте повреждённую поверхность 2%-м раствором питьевой соды.
Содержание и порядок выполнения работы:
Поместите в две пробирки металлы (гранулы или кусочки): в 1-ю — цинк, во 2-ю медь.
Налейте по 2 мл раствора соляной кислоты.
Сделайте вывод о том, в какой пробирке произошла химическая реакция.
Напишите молекулярное и ионные уравнения проведённой реакции.
Сформулируйте вывод о возможности взаимодействия кислот с металлами, вписав пропущенные слова в предложение.
Кислота взаимодействует с металлами согласно схеме:
Кислота + металл → соль + водород. (реакция замещения)
при следующих условиях:
- металл находится в электрохимическом ряду напряжений до или после водорода? (нужное подчеркнуть)
- в результате реакции образуется Растворимая или нерастворимая соль? (нужное подчеркнуть)
- для таких реакций не используют щелочные металлы, так как они взаимодействуют с водой (это условие в опыте не рассматривалось)
Подготовтесь к выступлению.
1 группа: взаимодействие оксида меди с азотной кислотой
CuO + 2HNO3 = Cu(NO3)2 +H2O нагреть голубой
Это реакция обмена. Оксиды — неэлектролиты, поэтому их записывают в молекулярном виде.
CuO + 2H + 2NO3 = Cu + 2NO3+ H2O
CuO + 2H = Cu + H2O
2 группа: взаимодействие гидроксида натрия с серной кислотой
2NaOH + H2SO4 = Na2SO4 + 2H2O
+ индикатор
Это реакция обмена.
2Na + 2OH + 2H + SO4= 2Na + SO4 + H2O
OH + H = H2O
3 группа: взаимодействие карбоната натрия с серной кислотой
Na2CO3 + HCl = 2NaCl+ H2O + CO2↑ Это реакция обмена.
2Na + CO3 + 2H + Cl= 2Na + 2Cl+ H2O + CO2↑
CO3 + 2H = + H2O + CO2↑
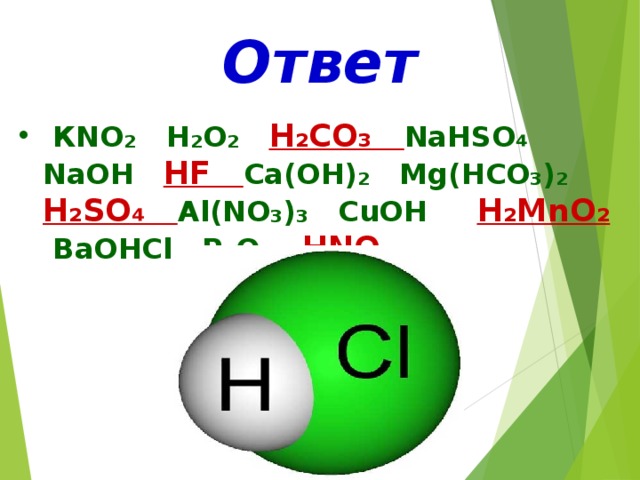
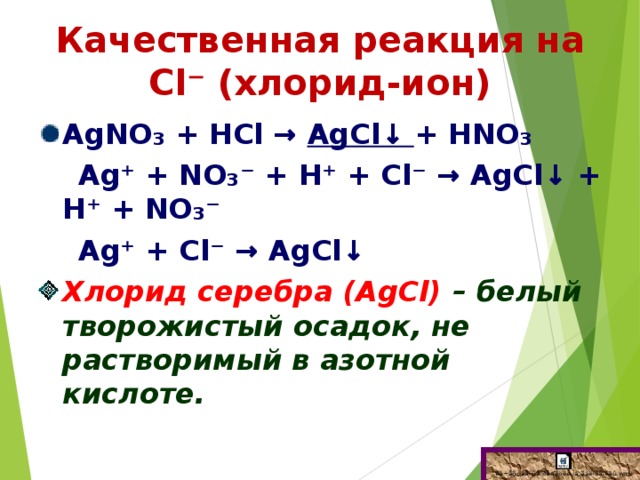
4 группа: взаимодействие нитрата серебра с соляной кислотой
AgNO3 + HCl = AgCl↓ + HNO3
Ag + NO3 + H + Cl = AgCl↓ + H + NO3 Это реакция обмена.
Ag + Cl = AgCl↓
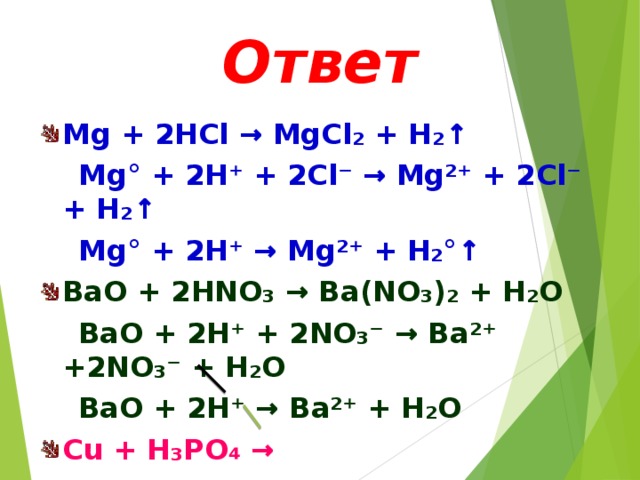
5 группа: взаимодействие цинка, бария и меди с соляной кислотой
Cu + HCl ≠
Zn + 2HCl = ZnCl2 + H2↑
хлопок
Кислоты взаимодействуют с металлами, если:
а) Металл стоит до водорода;
б) В результате реакций образуется растворимая соль;
в) Нерастворимая H2SiO3 не взаимодейсмтвует с металлами;
Металлы в ряду активности расположенны в порядке уменьшения их химической активности (вначале — самые активные, а в конце — неактивные или химически инертные металлы т.е. Благородные).
K, Al, Sn, Pb.
Cu, Hg, Au, Ag. С ними кислоты значит взаимодействовать не будут.