
Классификация и свойства неорганических веществ
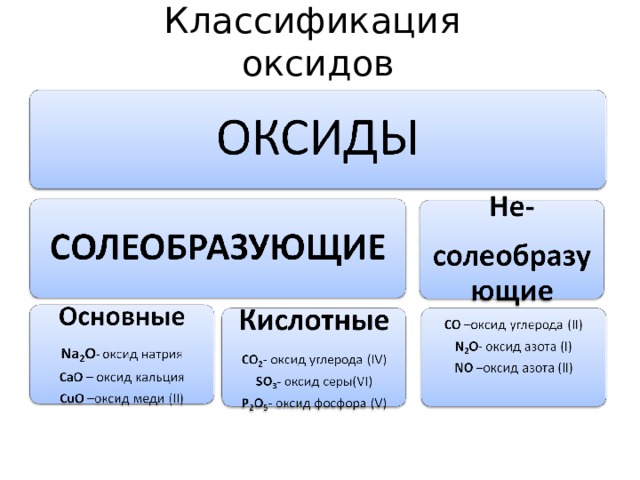
Классификация оксидов

Химические свойства основных оксидов
- Взаимодействуют с кислотными оксидами, образуя соли , поэтому основные оксиды являются солеобразующими: t 0
CaO + SiO 2 = CaSiO 3
2) Взаимодействуют с кислотами, образуя соль и воду, например: t 0
CuO + H 2 SO 4 = CuSO 4 + H 2 O
3) Взаимодействуют с водой, образуя щелочи, например:
Na 2 O +H 2 O = 2 NaOH

Химические свойства кислотных оксидов
- Взаимодействуют с металлами, образуя оксид металла и неметалл, например:
SiO 2 + 2 Mg = 2 MgO + Si
2) Взаимодействуют с основными оксидами, образуя соль, например: t 0
CaO + CO 2 = CaCO 3
3) Взаимодействуют с нерастворимыми основаниями, образуя соль и воду, например:
Cu(OH) 2 + SO 3 = CuSO 4 + H 2 O
4) Взаимодействуют с водой, образуя кислоты:
H 2 O + SO 3 = H 2 SO 4

Химические свойства амфотерных оксидов
- Обладают двойственной природой: одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Al 2 O 3 + 6 HCl = 2 AlCl 3 + 3 H 2 O
Al 2 O 3 + 6 NaOH = 2 Na 3 AlO 3 + 3 H 2 O
к числу амфотерных оксидов относятся оксид бериллия BeO , оксид цинка ZnO , оксид хрома (III ) Cr 2 O 3 , оксид железа ( III) Fe 2 O 3
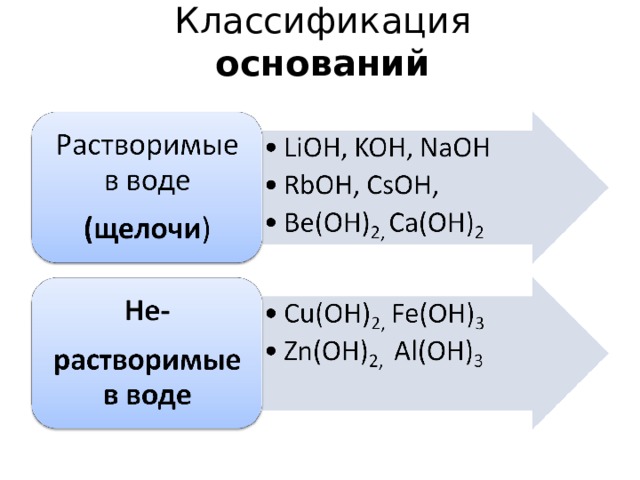
Классификация оснований

Химические свойства щелочей
- Способны реагировать с некоторыми неметаллами( галогенами, серой, белым фосфором, кремнием):
6 КОН + 3 Cl 2 = KCLO 3 + 5 KCl + 3 H 2 O
6 KOH + 3 S = K 2 SO 3 + 2 K 2 S + 3 H 2 O
2 NaOH + Si + H 2 O = Na 2 SiO 3 + 2 H 2
2) Взаимодействуют с кислотами – реакция нейтрализации, с образованием соли и воды,например:

Примеры
NaOH + HNO 3 = NaNO 3 + H 2 O
Cu(OH) 2 + H 2 SO 4 = CuSO 4 + H 2 O
3) Взаимодействует с кислотными оксидами, образуя соль и воду:
Ba(OH) 2 + SO 3 = BaSO 4 + H 2 O
4) Взаимодействуют с растворами солей, образуя нерастворимые основания и растворимую соль:
2 KOH + CuSO 4 = Cu (OH) 2 + K 2 SO 4
5) C водой образуют кристаллогидраты с различным содержанием воды

Химические свойства нерастворимых оснований
- Реагируют с кислотными оксидами, образуя соль и воду, например:
Cu(OH) 2 + SO 3 = CuSO 4 + H 2 O
2) Вступают в реакцию нейтрализации, т.е. взаимодействуют с кислотами, образуя соль и воду:
Al(OH) 3 + 3 HCl = AlCl 3 + 3 H 2 O
3) Разлагаются при нагревании: t 0
2 Fe(OH) 3 = Fe 2 O 3 + 3 H 2 O

Закрепление
- Напишите уравнения реакций, при помощи которых можно осуществить превращения: Cu
Cu CuO CuCl 2 Cu
CuSO 4
2) Какие из веществ, формулы которых приведены, реагируют с раствором гидроксида натрия: CaO , С u(OH) 2 , H 2 SO 4 , С O 2 , CuSO 4 , KCl , CuO , HCl ? Напишите уравнения практически осуществимых реакций.



































