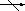Урок 3. Классификация неорганических соединений. Состав и свойства важнейших неорганических веществ.
Тип урока: обобщающий
Цель урока: обобщить знания о химических свойствах оксидов, оснований, кислот и солей. Доказать генетическую связь между классами неорганических соединений.
Задачи урока:
образовательные: изучить общие свойства кислот, оснований, солей; доказать, что данные свойства характерны для всех кислот, оснований, солей; повторить способы написания ионных уравнений реакций.
воспитательные: формировать умения учащихся работать в группах; оценивать ответы своих товарищей;
развивающие: стимулировать познавательную деятельность учащихся через химический эксперимент; развивать способность применения опорных знаний; повысить технику химического эксперимента у учащихся, развивать умения и навыки наблюдать, делать выводы.
Раздаточный материал: карточки с самостоятельной работой, исследовательские листы, брошюра «Химические свойства важнейших классов неорганических соединений».
Оборудование: презентация к уроку, мультимедийный проектор, штативы с пробирками, держатели для пробирок, сухое горючее, спички, приспособления для сжигания сухого горючего, салфетки;
Реактивы: кислоты: серная, соляная, фосфорная; основания: гидроксиды калия и натрия; соли: карбонат кальция, сульфат меди, хлорид бария, нитрат серебра, оксид меди, индикаторы: метилоранж, лакмус, фенолфталеин.
Ход урока:
I. Организационный момент.
Вводное слово учителя. Сообщение темы и задач урока.
II. Актуализация и мотивация знаний.
Самостоятельная работа в тестовой форме по теме «ПЗ и ПСХЭ Д.И. Менделеева».
Каждому ученику выдается раздаточный материал с заданиями самостоятельной работы. На выполнение работы отводиться 5-7 мин.
III. Обобщение знаний.
Повторение опорных знаний:
Слайд № 1 – Оксиды
Слайд № 2 – Основания
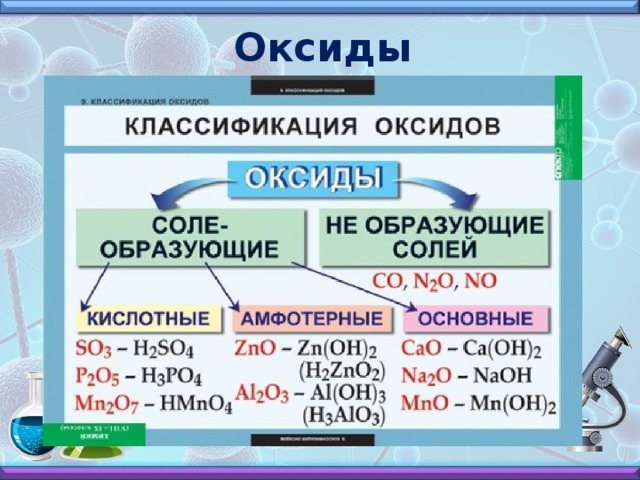
Слайд № 3 – Кислоты
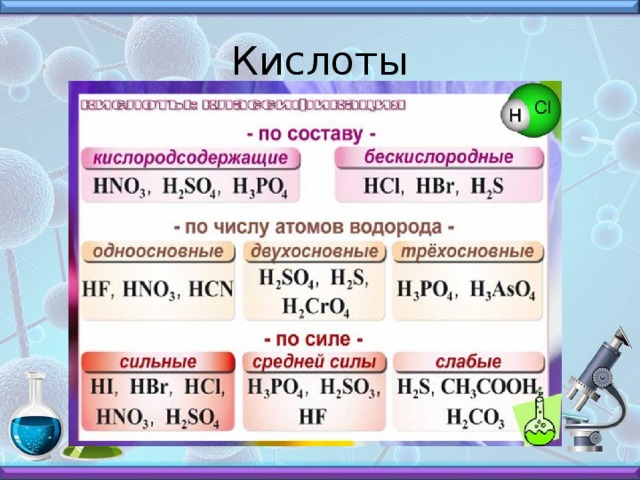
Слайд № 4 - Соли
Слайд № 1.
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.

Слайд № 2.
Основания – это сложные вещества, в состав которых входят атомы металлов, соединенных с одной или несколькими группами атомов OH.
Основания
![]()
![]()
Нерастворимые
Cu(OH)2, Fe(OH)3
Растворимые (щелочи)
NaOH, KOH
Слайд № 3.
Кислоты – это сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.
Кислоты
![]()
![]()
Кислородосодержащие
HNO3, H2SO4, H3PO4
Бескислородные
HCl, H2S
Слайд № 4.
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками. Соли
![]()
![]()
![]()
Основные
Mg(OH)CL
Кислые
KHSO4, KH2PO4,
Средние
NaCL, Na2SO4
IV. Физкультминутка.
V. Выполнение экспериментальной работы.
Инструктаж по технике безопасности, правилам выполнения экспериментальной работы, получение и заполнение исследовательских листов.
Выполнение экспериментальной работы. Каждая команда учащихся работает по инструкциям своего варианта (см. приложение «Варианты исследовательских листов), результаты исследований записываются в рабочие тетради, формулируют выводы по проделанной работе. При работе используются брошюра «Химические свойства важнейших классов неорганических соединений».
Подведение итогов урока, оценивание результативности команд.
VI. Рефлексия.
Ученики дают оценку работе на уроке:
сегодня я узнал…
было интересно узнать…
было трудно выполнять…
теперь я могу решать..
я научился…
у меня получилось…
я смог…
VII. Домашнее задание.
Осуществить цепочку превращений:
![]()
![]()
![]()
![]()
![]()
Al Al2O3 AlCl3 Al(OH)3 Al2O3 Al(NO3)3
ПРИЛОЖЕНИЕ 1
ИССЛЕДОВАТЕЛЬСКИЙ ЛИСТ
ВАРИАНТ № 1
Цель исследования: изучить общие химические свойства кислот, доказать, что данные свойства характерны для всех кислот.
| № | Исследуемое свойство | Что делали | Что наблюдали | Уравнения реакций |
| 1. | Действие на индикатор | Взять три чистые пробирки. Налить в каждую немного кислоты. Добавить в одну – лакмус, в другую – фенолфталеин, в третью – метилоранж. Описать изменение цвета растворов. |
|
|
| 2. | Взаимодействие с оксидом металла | В чистую пробирку насыпать немного CuO, добавить кислоты. Пробирку укрепить в держателе, нагреть до кипения. Описать изменение цвета раствора. |
|
|
| 3. | Взаимодействие с основанием | В пробирку налить немного NaOH , добавить каплю фенолфталеина. Прилить кислоты. Описать изменение цвета раствора. |
|
|
| 4. | Взаимодействие с солью | В пробирку насыпать немного CaCO3. Прилить кислоты. Описать наблюдаемый процесс. |
|
|
ВЫВОДЫ:
ПРИЛОЖЕНИЕ 2
ИССЛЕДОВАТЕЛЬСКИЙ ЛИСТ
ВАРИАНТ № 2
Цель исследования: изучить общие химические свойства оснований, доказать, что данные свойства характерны для всех оснований.
| № | Исследуемое свойство | Что делали | Что наблюдали | Уравнения реакций |
| 1. | Действие на индикатор | Взять три чистые пробирки. Налить в каждую немного щелочи NaOH. Добавить в одну – лакмус, в другую – фенолфталеин, в третью – метилоранж. Описать изменение цвета растворов. |
|
|
|
|
|
|
|
|
| 2. | Взаимодействие с кислотой | В пробирку налить немного NaOH , добавить каплю фенолфталеина. Прилить кислоты. Описать изменение цвета раствора. |
|
|
| 3. | Взаимодействие с солью | В пробирку налить немного CuSO4. Прилить щелочи. Описать наблюдаемый процесс. |
|
|
| 4. | Разложение нерастворимых оснований при нагревании | Пробирку с полученным в 3 опыте гидроксидом меди укрепить в держателе. Вещество нагреть до кипения. Описать изменение цвета. |
|
|
ВЫВОДЫ:
ПРИЛОЖЕНИЕ 3
ИССЛЕДОВАТЕЛЬСКИЙ ЛИСТ
ВАРИАНТ № 3
Цель исследования: изучить общие химические свойства солей, доказать, что данные свойства характерны для всех солей.
| № | Исследуемое свойство | Что делали | Что наблюдали | Уравнения реакций |
| 1. | Взаимодействие с кислотой | В пробирку насыпать немного CaCO3. Прилить кислоты. Описать наблюдаемое явление. |
|
|
| 2. | Взаимодействие с основанием | В пробирку налить немного CuSO4. Добавить щелочи NaOH. Описать происходящее явление. |
|
|
| 3. | Взаимодействие с солью | В пробирку налить немного раствора BaCL2. Прилить раствор AgNO3. Описать наблюдаемый процесс. |
|
|
ВЫВОДЫ: