

1 задание.
На сколько групп и по каким признакам можно разделить вещества , формулы которых приведены ниже?
Na 2 O ; MgO ; NaOH ; О 2 ; КОН ; Al 2 O 3 ; Ca (OH) 2 ; Са O ; А l; Н 2 ;
N 2 ; Al(OH) 3 ; S ; СО 2 ;
SO 3 ; Ca; Na
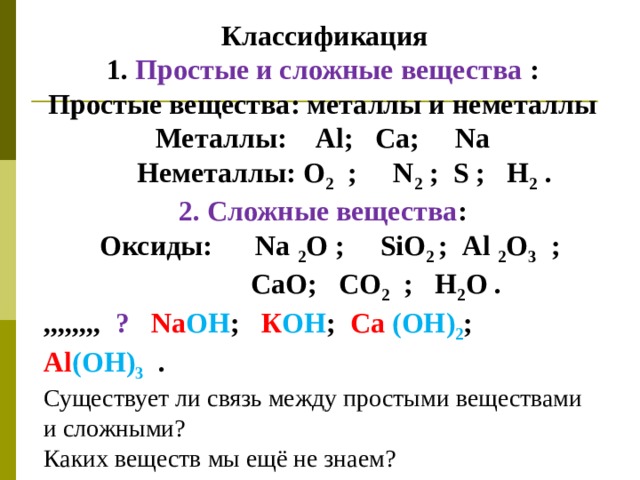
Классификация
1. Простые и сложные вещества :
Простые вещества: металлы и неметаллы Металлы: А l ; Ca ; Na
Неметаллы: О 2 ; N 2 ; S ; Н 2 .
2. Сложные вещества :
Оксиды: Na 2 O ; SiO 2 ; Al 2 O 3 ;
Са O ; СО 2 ; Н 2 О .
,,,,,,,, ? Na OH ; К ОН ; Ca ( OH ) 2 ; Al ( OH) 3 .
Существует ли связь между простыми веществами и сложными?
Каких веществ мы ещё не знаем?
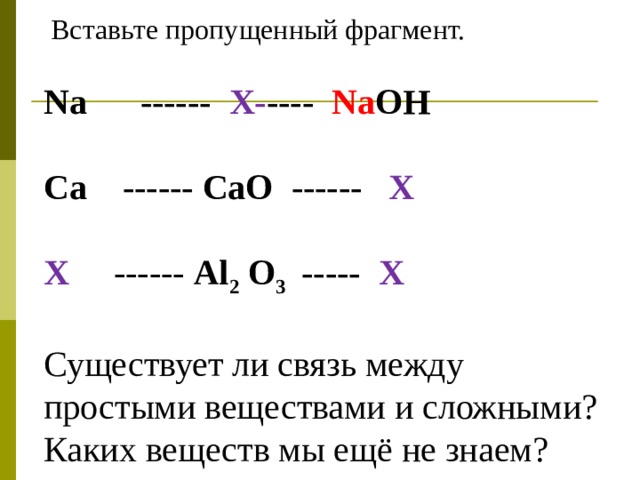
2 задание .
Вставьте пропущенный фрагмент.
Na ------ Х- ---- Na OH
Ca ------ CaO ------ Х
Х ------ Al 2 O 3 ----- Х
Существует ли связь между простыми веществами и сложными?
Каких веществ мы ещё не знаем?
.
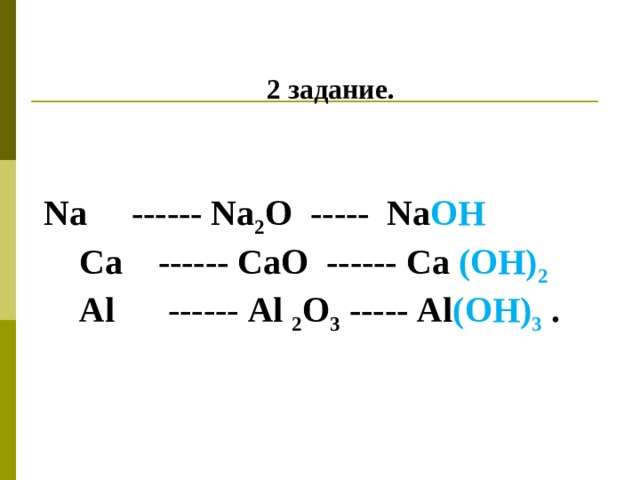
2 задание .
Na ------ Na 2 O ----- Na OH
Ca ------ CaO ------ Ca ( OH ) 2
А l - ----- Al 2 O 3 ----- Al ( OH) 3 .


ПЛАН
1.Основания.Определение, состав.
2.Номенклатура.
3.Классификация.

3 задание.
Определить : почему у оснований разное количество групп -ОН? Дайте обоснованный ответ.
Na О H Ca ( OH) 2 Al ( OH) 3

3 задание.
Na +1 Ca +2 Al +3
Имеют разную степень окисления.

Определите степени окисления каждого элемента в формуле гидроксид- иона
Гидроксид- ион имеет суммарный заряд:
( О -2 Н +1 ) - или ОН -

1.Основания
Выведем общую формулу оснований?
Ме + n ( ОН -1 ) n

Основания – это сложные вещества, состоящие из ионов металлов и гидроксид- ионов.

4 задание.
Составьте формулы оснований элементов под номерами:
3, 12, 31, 26,
Проанализируйте составленные формулы оснований : по общей формуле, по степени окисления металла.

4 задание.
Li +1 OH -1
Mg +2 ( OH ) -1 2
Ga +3 ( OH) 3
Fe +2 (OH) -1 2 и Fe +3 ( OH) -1 3

2.Номенклатура
5 задание.
Дайте название основаниям, учитывая степень окисления металла
КОН;
Fe ( ОН) 2 ;
Fe ( OH ) 3 ;
С u ( OH ) 2 ;
Ва( ОН) 2 ;
С u О H
Ca ( OH ) 2 ;
Al ( OH ) 3;

5 задание.
КОН- гидроксид калия;
Fe (ОН) 2 – гидроксид железа( II );
Fe ( OH ) 3 - гидроксид железа( III );
С u ( OH ) 2 - гидроксид меди( II );
Ва(ОН) 2 – гидроксид бария;
С u О H - гидроксид меди( I );
Ca ( OH ) 2 - гидроксид кальция
Al ( OH ) 3 - гидроксид аллюминия

5 задание.
КОН- гидроксид калия;
Fe (ОН) 2 – гидроксид железа( II );
Fe ( OH ) 3 - гидроксид железа( III );
С u ( OH ) 2 - гидроксид меди( II );
Ва(ОН) 2 – гидроксид бария;
С u О H - гидроксид меди( I );
Ca ( OH ) 2 - гидроксид кальция
Al ( OH ) 3 - гидроксид аллюминия
3 Классификация
Определите группы оснований
а) по количеству групп -ОН

6 задание
Однокислотные:
КОН- гидроксид калия;
Двухкислотные:
Fe (ОН) 2 – гидроксид железа( II );
С u ( OH ) 2 - гидроксид меди( II );
Ва (ОН) 2 – гидроксид бария;
Трёхкислотные:
Fe ( OH ) 3 - гидроксид железа( III );

б) по растворимости:
Определите растворимость оснований двумя способами:
-лабораторным
Правила техники безопасности:
Что делать, если попала на руки щёлочь?
лабораторный опыт №1
-прибавьте в первую пробирку к таблетке N аОН 5-10 мл воды ;
- прибавьте во вторую пробирку к С u (ОН) 2 ( голубое вещество) 5-10 мл воды .
Что произошло?
Вывод:
Как без опыта узнать растворимое основание или нет?
- Как без опыта узнать растворимое основание или нет?
-По таблице растворимости.
- -По таблице растворимости.

Гидроксид натрия

Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они очень гигроскопичны.

Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани, древесину.

Гидроксид калия повреждает ткань

« В жизни нет ничего лучшего, чем собственный опыт»
В. Скотт.

Практическое задание №2
Как узнать в какой пробирке щелочь?
- прибавьте в пробирку №1 со щелочью универсальный лакмус
- в пробирку №2 с водой универсальный лакмус
Что произошло?
Результаты опыта оформите в таблицу:


7 задание
Игра « Третий лишний»
Na OH ; КОН; СаО.
Na OH ; КОН; Са ( OH ) 2
С u(OH) 2 ; Fe(OH) 3 ; Fe (OH) 2 ;
Na OH ; С u ( OH ) 2 ; Fe ( OH ) 2 .
Na OH ; Fe (OH) 2 ; КОН

7 задание
Выбери лишнее вещество и объясни почему?
1. Са O - т.к. оксид
2. Ca ( OH ) 2 -т.к. двухкислотное основание.
3. Fe ( OH ) 3 - т.к. трёхкислотное основание.
- NaOH - т.к. растворимое основание (щёлочь)
- Fe ( OH ) 2 - т. к . нерастворимое основание

Домашнее задание

Верите или нет
1) нет
2) да
3) нет
4) да
5) нет
6) да
7) да
8) да
9) нет
10) да

Рефлексия
1. Сегодня я узнал…
2. Было интересно…
3. Было трудно…
4. Я выполнял задания…
5. Я понял, что…
6. Теперь я могу…
7. Я почувствовал, что…
8. Я приобрёл…

9. Я научился…
10. У меня получилось…
11. Я смог…
12. Попробую…
13. Меня удивило…
14.Урок мне дал для жизни…
15. Мне захотелось…























































