| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
| Московский областной политехнический колледж– филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (МОПК НИЯУ МИФИ) |
КОНСПЕКТ ЛЕКЦИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ ОП.04.
ОРГАНИЧЕСКАЯ ХИМИЯ
по специальности
среднего профессионального образования
18.02.03 «Химическая технология неорганических веществ»
Типы химических связей в молекулах органических соединений
Электросталь, 2022
СОДЕРЖАНИЕ
1.СТРОЕНИЕ АТОМА УГЛЕРОДА………………………………………………….3
2 ДИПОЛИ ……………………………………………………………………………..4
3.О ПРИРОДЕ КОВАЛЕНТНЫХ ХИМИЧЕСКИХ СВЯЗЕЙ…………………………………………………………………………………5
4.ЭЛЕКТРОННОЕ СТРОЕНИЕ ПРОСТЫХ КОВАЛЕНТНЫХ СВЯЗЕЙ………….6
5. ЭЛЕКТРОННОЕ СТРОЕНИЕ КРАТНЫХ (ДВОЙНЫХ И ТРОЙНЫХ) СВЯЗЕЙ…………………………………………………………………… 6
ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ УЧЕБНЫХ ИЗДАНИЙ……………………….8
ЭЛЕКТРОННЫЕ ПРЕДСТАВЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ И ПРИРОДА ХИМИЧЕСКИХ СВЯЗЕЙ
Применение электронных представлений в органической химии явилось одним из важнейших этапов развития теория строения.
1. Строение атома углерода. Причину крайнего своеобразия и многочисленности органических соединений необходимо искать прежде всего в строении атома углерода.
Строение атома С, находящегося в первом ряду ІУ гр. периодической системы Менделеева, можно выразить схемой.

Атом С во внутреннем электронном слое, соответствующем атому инертного газа гелия, имеет 2 электрона, в следующем, внешнем электронном слое, атом С имеет 4 электрона, являющихся валентными. Из курса неорганической химии известно, что. наличие во внешнем электронном слое малого числа электронов (у элементов I, II, III гр.) приводит к легкой потере этих электронов и превращению атомов в катионы (Na+, Са2+ Аl3+ ). С другой стороны, наличие большого числа электронов во внешнем слое, наиболее характерное для УП гр., приводит к легкости присоединения электронов и превращению атомов в анионы (Cl-). В обоих случаях проявляется тенденция к созданию прочных восьми - или двух-электронных оболочек, характерных для инертных газов.
Центральное положение С - именно в 4 гр. - приводит к тому, что его атом не склонен ни терять электроны, ни приобретать свободные электроны с образованием анионов.
Прочность валентных электронов атома С зависит также от близости их к положительно заряженному атомному ядру: они отделяются от него лишь двухэлектронным слоем. Благодаря этому обстоятельству у атома углерода валентные электроны удерживаются в атоме прочнее, чем у атомов других элементов с четырьмя валентными электронами. Так, у кремния, следующего
за С элемента ІУ гр., валентные электроны отделены двумя
электронными слоями, имеющими 2 и 8 электронов, поэтому взаимодействие между ядром и валентными электронами ослаблено.
Эти особенности строения электронных оболочек атома с являются причиной образования в органических соединениях химических связей, существенно отличающихся по своему характеру от связей, характерных для большинства диссоциирующих на ионы неорганических соединений.
Долгое время было не ясно, каким образом удерживаются атомы в большинстве органических соединений, которые не способны существовать в виде ионов.
Одним из первых ученых, распространивших электронные представления на органические соединения, был русский ученый А.М. Беркенгейм. Он считал, что связь в органических соединениях осуществляется также при помощи электронов, но только валентный электрон не полностью переходит из одного атома в другой, а лишь смещается из своего нормального положения по направлению к другому атому.
Дальнейшим развитием электронных представлений явилась
теория Косселя, Льюиса и Лонгмюра. В этой теории признается, что связь в органических соединениях осуществляется электронами, которые не переходят от одного атома к другому, а становятся общими для соседних атомов. Но в отличие от теории Беркенгейма по Косселю и Люису простая связь
осуществляется не одним, а двумя электронами, которые становятся общими.
Вследствие этого данную теорию часто называют теорией электронных пар.
Атом С, не имея способности терять свои валентные электроны, легко образует октеты, притом как с атомами обычно легко отдающими электроны (Н), так и с атомами легко приобретающими их (Cl).
Двойная связь, при которой на соединение атомов углерода затрачивается по две единицы средств ,обусловлена двумя парами общих электронов.
Тройная связь обусловлена существованием трех пар общих
электронов.
Химические связи, осуществляемые одной, двумя или тремя парами электронов, являющимися общими для соседних атомов, называются ковалентными связями. В органических соединениях ковалентные связи являются наиболее широко распространенными, однако в некоторых органических соединениях (органические кислоты и их соли) наряду с ковалентными связями встречаются и электровалентные (в основе которых лежит электростатическое притяжение ионов).
2.Диполи. Пара общих электронов, образующих ковалентную связь, в равной степени принадлежит обоим атомам, если эти атомы совершенно равноценны, например, два атома Н в молекуле Н2 или атомы С в молекуле этана.
Гораздо чаще в молекуле связаны неодинаковые атомы или же одинаковые, но соединенные в свою очередь с различными соседними атомами или группами атомов. В этих случаях пара общих электронов не в равной степени принадлежит обоям атомам, а сдвинута в сторону какого-либо одного атома. Так, в связи C-Cl общая пара электронов сдвинута к более сильно притягивающему электроны атому хлора.
Диссоциации, т.е. образования ионов, здесь не происходит, т.к. валентные электроны углерода прочно связаны с ядром. Однако часть молекулы, в которой содержится атом хлора, будет иметь несколько более отрицательный заряд по сравнению с соседним атомом углерода
Аналогичное явление наблюдается у связи углерода и кислорода и во многих других случаях, когда благодаря сдвигу электронов исчезает совпадение центра тяжести положительных и отрицательных зарядов.
Система, характеризующаяся несовпадением центров тяжести электроположительных и электро-отрицательных зарядов и появлением вследствие этого двух полюсов, называется диполем.
Степенью сдвига электронов, в различных случаях различно, определяется степень подвижности атомов, т.е. их способность вступать в различные реакции.
3.О природе ковалентных химических связей.
Новым этаном развития теории строения и познания сущности химической связи явилось применение в органической химии квантовой механики.
Квантовая механика - это механика микромира, мира этомов, электронов, молекул.
Квантовая механике существенно изменила представления о строении атома. Если по Бору, атом водорода состоит из положительно заряженного ядра, вокруг которого по круговой орбите вращается электрон в виде точечного заряда, то с позиций квантовой механики картина строения атома водорода иная: электрон двигается не по определенной орбите, а может находиться в любом месте вокруг ядра атома.
Однако вероятность его нахождения в различных местах атома не одинакова. Картина распределения величины вероятности нахождения электрона в пространстве вокруг ядра обычно обозначается как электронное облако.
Если проследить плотность электронного облака (т.е, вероятность нахождения электрона), то окажется, что у самого ядра она равна нулю, потом быстро возрастает, достигая максимального значения, в затем постепенно убывает.
Строения много электронных атомов весьма сложно, т.к. различные электронные облака обладают различной энергий, формой, различным распределением электронной плотности и т.д.
Согласно принципу Паули в атоме, как правило, не может быть двух совершенно одинаковых по состоянию электронов. Они должны отличаться или формой облака, или распределением электронной плотности, или, наконец, различным взаимным пространственным расположением.
Атом С в возбужденном состоянии в наружном слое имеет один электрон сферической формы- S - электрон и три электрона в форме объемной восьмерки, расположенных в трех взаимно перпендикулярных направлениях. При образовании соединений происходит так называемая гибридизация электронов, заключающаяся в возникновении промежуточных по форме электронных облаков.
Из одного S - и трёx Р -электронов образуются четыре одинаковых по форме электрона - Sp3 - электроны.
Форма гибридизиоованного sp3 электронного облака такова:
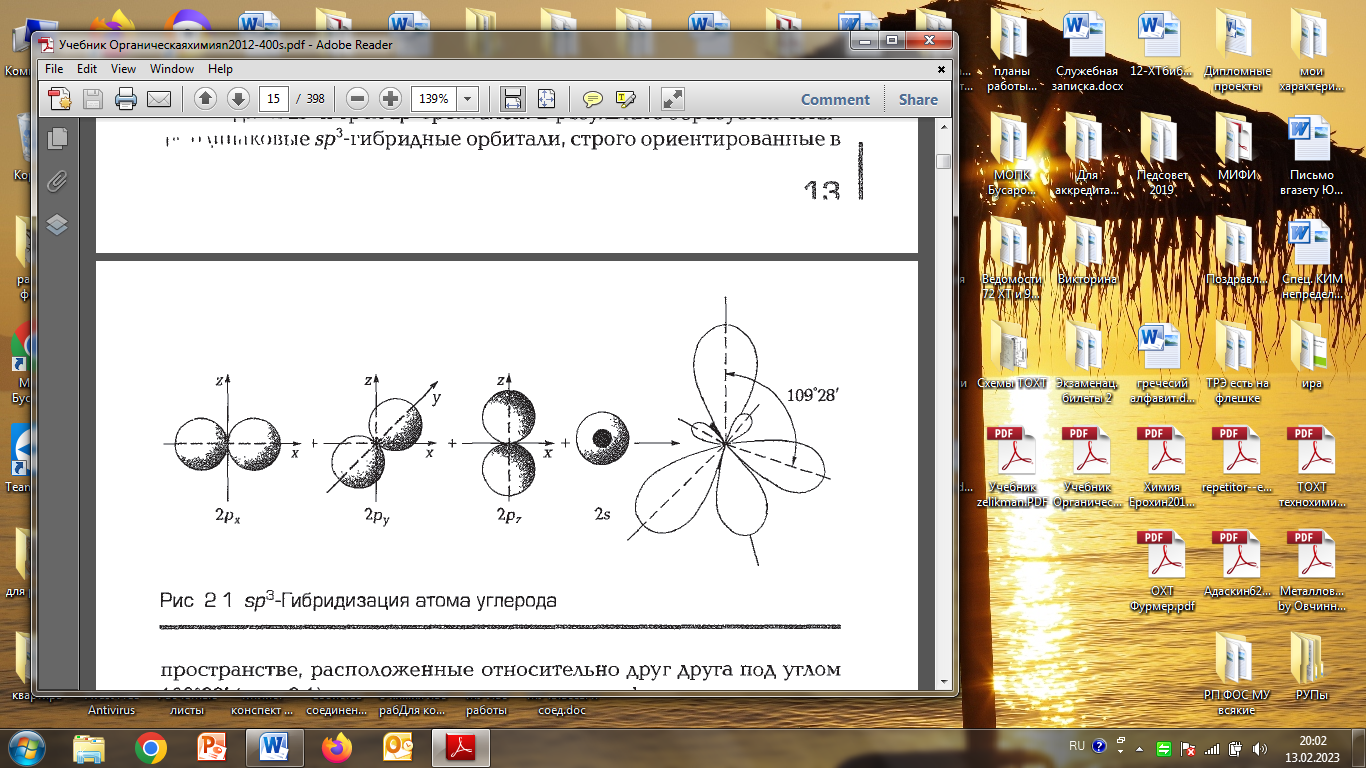
Четыре таких гибридизированных электронных облака расположены пространстве под углом 109 028 .
4.Электронное строение простых ковалентных связей.
Образование ковалентной химической связи происходит при взаимном перекрывании электронных облаков двух атомов, причем связь создается в том направлении, в котором происходит наибольшее перекрывание электронных облаков.
Причиной образования ковалентной химической связи 2 атомов, как показывают квантово-механические расчеты, является то, что при сложении атомов до определенного расстояния система 2 ядер, находящихся в поле 2 электронов с определенным распределением электронных плотностей, оказывается энергетически наиболее выгодной.
Связи в приведенных случаях осуществляются за счет S- электронов (или гибридизированных S - и Р - злектронов) и называются 6-связями. Главным признаком, характеризующим сигма - связи, является то, что наибольшее перекрывание электронных облаков, их образующих, находится на прямой, соединяющее центры атомов.
Квантовая механика объяснила не только сущность ковалентной химической связи, но и пространственную направленность связей.
Так как 4 гибридизированных электронных облака 4-валентного углеродного атома направлены под углом109028 к углам тетраэдра,сигма- связи такого атома будут направлены под такими же углами, что и объясняет "тетраэдрическую" форму атома углерода.
5.Электронное строение кратных (двойных и тройных) связей.
Согласно современным представлениям кратные ковалентные (двойные и тройные) связи неодинаковы, т.е, электронное строение 2 связей, соединяющих, например, два атома углерода в этилене, различно. Из 4 валентных электронов каждого углеродного атома S - электрон и два Р-электрона гибридизируются (SP2- гибридизация), образуя три гибридизированных электрона, а один Р-электрон остается в "чистом" виде. Три гибридизированных электрона каждого углеродного атома образуют обычные сигма - связи (одну С-С и две связи С-Н).
В молекуле этилена имеется 5 таких сигма - связей, расположенных в одной плоскости и составляющих каждая с соседей связью угол 120 0.
Оставшиеся негибридизированными Р - электроны ненасыщенных углеродных атомов образуют вторую связь, соединяющую углеродные атомы этилена. Эти электронные облака имеют форму объемных восьмерок и расположены в плоскости, перпендикулярной плоскости расположения остальных сигма-связей. Такая связь называется пи - связью она качественно отличается от сигма - связи.
Форма гибридизиоованного sp2 электронного облака такова:


В случае тройных связей, как в ацетилене, из 4 - валентных электронов каждого атома углерода S- электрон гибридизирован с одним Р - электроном ( SP - гибридизация), а два Р - электрона остаются в "чистом" виде. Одна из 3 связей, соединяющих атомы углерода, представляет собой 6 - связь, а две остальные пи-связи, сигма - связь образована гибридизированными SP - электронами, а пи - связи -двумя парами негибридизированных Р - электронов.

В молекуле ацетилана три сигма-связи, т.е. валентные углы Н-С-2 и С-С-Н = 180°, т. е. молекула ацетилена прямолинейна.
Две П-связи, образованные двумя парами Р-электронов, находятся в двух взаимоперпендикулярных плоскостях
Подобное электронное строение имеют двойные и тройные связи не только в тех случаях, когда они соединяют атомы углерода, но и тогда, когда атом углерода связан с атомами других элементов. Так, в грушах С = О и N= С одна связь - это сигма - связь, а другая пи - связь; в нитрильной груше С= N
имеется одна сигма- связь и две пи - связи. Когда пи - связь соединяет два различных атома, она бывает поляризованной, т.е. электронные облака, образующие ее, сдвинуты в сторону атома более электроотрицательного элемента.
Новые представления о химической связи вошли как составная часть в теорию строения, и под строением молекул нужно понимать не только определенный порядок соединения атомов при помощи той или иной доли химического сродства, но и взаимное расположение атомов в пространстве, и электронное строение соединяющих их связей, включая то или иное распределение электронных плотностей (что в свою очередь отражается на химических свойствах молекул).
Перечень рекомендуемых учебных изданий.
Основные источники:
Грандберг И.И. Органическая химия: учебник для студ. СПО. 8- изд.– М.: Юрайт, 2017.
Захарова Т.Н., Глаголева Н.А. Органическая химия: учеб. для студ. учреждений СПО.-М.: Издательский центр «Академия», 2018.






















