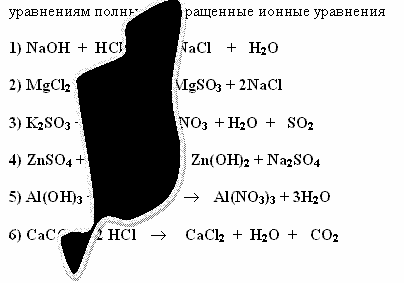Конспект урока: Ионные уравнения
Наш урок я бы хотела начать со слов
Дорога к знанию?
Ну что - же, её легко понять, ответить можно сразу - мы ошибаемся, и ошибаемся, и ошибаемся опять, но меньше, меньше с каждым разом.
Фронтальная беседа (3 мин)
Что такое электролитическая диссоциация? (процесс распада молекул электролитов на ионы при растворении в воде или расплавлении)
Что такое ионы? (это заряженные частицы, которые отличаются от атомов числом электронов)
На какие группы делятся ионы? (катионы – положительные ионы; анионы – отрицательные ионы)
На какие ионы распадаются при электролитической диссоциации кислоты (ионы водорода и ионы кислотного остатка)
На какие ионы распадаются при электролитической диссоциации растворимые основания? (ионы металла и ионы ОН-1 групп)
На какие ионы распадаются при электролитической диссоциации соли? (ионы металла и ионы кислотного остатка)
Таким образом, какие ионы выделяют при электролитической диссоциации? (Н+1, ОН-1, Ме+n, кислотный остаток-n)
Именно эти ионы находятся в таблице растворимости: (Работа с таблицей растворимости – определение растворимых и нерастворимых веществ)
-Посмотрите, на экран::
Электролиты (слабые, сильные)
Не электролиты
Электролитическая диссоциация
Степень диссоциации
Ионы
Катионы
Анионы
Ионные уравнения
Какое понятие нам не знакомо?
(отвечают: Ионные уравнения).
Совершенно верно это и будет тема нашего урока.
Вы уже знакомы с реакциями обмена (дайте определение).
Вам также известно, что данные реакции возможны лишь в тех случаях ( продолжите)- если в результате реакции выделяется осадок или газ или вода.
До изучения теории электролитической диссоциации реакции обмена рассматривались как взаимодействие кислот, оснований и солей. Теперь вам известно, что в растворах этих веществ молекул практически нет, а есть-?- ионы водорода, гидроксид-ионы, ионы металлов и кислотных остатков.
Отсюда следует вывод, что реакции между растворами этих веществ сводятся к взаимодействию ионов.
- Как будут называться реакции, состоящие из ионов?
-ионные реакции
- А как будут называться уравнения, состоящие из ионов?
-ионные уравнения (откройте учебник на стр 68 и сравните правильно ли мы с вами дали определения ионным реакциям и ионным уравнениям?
Итак, опираясь на знания о реакциях обмена и условиях их протекания до конца, а также электролитической диссоциации кислот, солей, оснований при растворении в воде, на сегодняшнем уроке мы узнаем, какие реакции называются реакциями ионного обмена и научимся составлять ионные уравнения.
Выполним лабораторные опыты, и ответим на вопросы: но прежде чем мы приступим к эксперименту, давайте вспомним правила по ТБ при работе с кислотами и щелочами. ( инструктаж ТБ)
1.Будет ли происходить реакция между растворами
хлорида натрия и серной кислоты?
2 NaCl+H2SO4=Na2SO4+2 HCl (молекулярное уравнение)
2.Почему нет видимых признаков реакции?
3.Может ли молекулярное уравнение объяснить это наблюдение?
4.Что должна содержать запись уравнения, что бы могли дать объяснение?
Для объяснения реакций происходящих в растворах необходимо кроме молекулярного уравнения нужно наверно показать, что в реакции участвуют не молекулы а ионы и записать ионное уравнение
2 Na++2Cl-+2H++ SO42-=2 Na++SO42+2H++2Cl- (полное ионное уравнение)
Можете теперь объяснить, почему мы не увидели?
-потому- что смесь исходных ионов не изменилась
Теперь давайте проделаем тот же опыт, но заменим хлорид натрия на хлорид бария. Что произошло?
-выпал осадок
-запишите молекулярное уравнение
B aCl2+ H2SO4= BaSO4+2 HCl
aCl2+ H2SO4= BaSO4+2 HCl
-что нужно сделать?- правильно –посмотреть по таблице растворимости какое вещество нерастворимо и поставить соответствующий знак.
А вот чтобы составить ионное уравнение нужно использовать алгоритм составления ионных уравнений, он лежит у вас на партах
Я покажу как им пользоваться, итак:
B a2++2Cl-+2H++ SO42-= BaSO4+2H++2Cl- мы составили полное ионное уравнение, но это еще не все, теперь зачеркните формулы одинаковых ионов, сравнивая левую и правую часть уравнения.
a2++2Cl-+2H++ SO42-= BaSO4+2H++2Cl- мы составили полное ионное уравнение, но это еще не все, теперь зачеркните формулы одинаковых ионов, сравнивая левую и правую часть уравнения.
Запишите формулы оставшихся ионов и веществ. Если в сокращённом ионном уравнении коэффициенты перед ионами и молекулами имеют общий множитель, то их нужно сократить, и в начале записывают катион ,а затем анион, и мы получим сокращенное ионное уравнение
B a2++SO42-= BaSO4
a2++SO42-= BaSO4
В чем сущность данной реакции?
Что образовалось в результате реакции? (Сущность данной реакции сводится к взаимодействию ионов Ba2+ и SO42-; в результате этого взаимодействия образуется осадок BaSO4)
Данные ионы могли входить в состав любого электролита и наблюдалась бы аналогичная реакция.
-Кроме образования осадка признаком необратимости может служить еще выделение газа. Найдите у себя на столе растворы карбоната натрия и хлороводородной кислоты. Это электролиты
- Соедините эти растворы. Что мы наблюдаем?
Д: Выделяется газ.
- А какой? На этот вопрос нам поможет ответить уравнение(вызываю записать, пользуясь алгоритмом)
Na2CO3 + 2 HCl → 2 NaCl + H2CO32↑ + H2O
2Na+ +CO32- + 2 H+ +2Cl- → 2 Na++2Cl- + CO2↑ + H2O
CO32- + 2 H+→ CO2↑ + H2O
-Иногда явных признаков необратимости не наблюдается, в таких случаях только уравнение и таблица растворимости могут быть справочниками. Найдите и соедините в пробирке гидроксид натрия и соляную кислоту. Что-то произошло?
Д: Нет (-)
- А есть ли у нас среди реактивов подсказка, выручалочка именно для такого случая) Д: Фенолфталеин (**) ( в щелочах малиновый)
- Проведем этот опыт еще раз, только в присутствии фенолфталеина:
NaOH + ф-ф + HCl – Обесцвечивание.
-А почему? – Изменилась среда раствора (*)
Запишем уравнение: NaOH + HCl → NaCl + H2O
Na++OH- + H++Cl- → Na++Cl- + H2O
Вода – малодиссоциирующее вещество, слабый электролит, поэтому записываем ее формулу в молекулярной форме.
Реакция нейтрализации может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями.
Демонстрационный эксперимент
Cu(OH)2 + HCl = CuCl2 + H2O
Что наблюдаете? Запишите уравнения реакции
В чем сущность данной реакции?
Что образовалось в результате реакции? (Сущность данной реакции сводится к взаимодействию ионов Cu2+ и 2OH-; в результате этого взаимодействия образуется осадок Cu(OH)2)
Данные ионы могли входить в состав любого электролита и наблюдалась бы аналогичная реакция.
Давайте все вместе сделаем общие выводы.
-Реакции в водных растворах электролитов являются реакциями между ионами, и поэтому их изображают в виде ионных уравнений.
-Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (вода)
Если НЕ образуются осадок, газ и вода, то реакции являются обратимыми (слайд 6):
Определение:
Обратимые реакции – это реакции, которые при одних и тех же условиях протекают в двух противоположных направлениях
III. Закрепление изученного материала (20 мин)
Учащимся предлагается выполнить задания в парах. Каждое задание предлагается на слайде и проверяется на следующем слайде (слайдах).
Задание 1 (Слайд 10)Саша и Алеша делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным
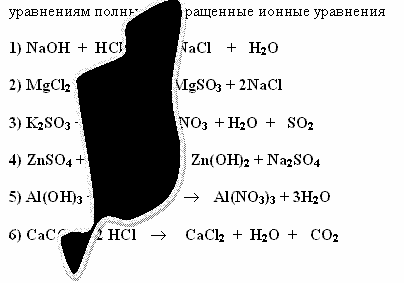
Проверка задания 1 (слайды 11, 12).
1) NaOH + HCl  NaCl + H2O
NaCl + H2O
Na+ + OH- + H+ + Cl-  Na++ Cl- + H2O
Na++ Cl- + H2O
OH- + H+ H2O
H2O
2) MgCl2 + Na2SO3  MgSO3
MgSO3 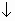 + 2NaCl
+ 2NaCl
Mg2+ + 2Cl- + 2Na+ + SO32-  MgSO3
MgSO3 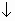 + 2Na+ +2Cl-
+ 2Na+ +2Cl-
Mg2+ + SO32-  MgSO3
MgSO3 
3) K2SO3 + 2HNO3  2KNO3 + H2O + SO2
2KNO3 + H2O + SO2 
2K+ + SO32- + 2H++ 2NO3-  2K+ + 2NO3- + H2O + SO2
2K+ + 2NO3- + H2O + SO2 
SO32- + 2H+  H2O + SO2
H2O + SO2 
4) ZnSO4 + 2NaOH  Zn(OH)2
Zn(OH)2  + Na2SO4
+ Na2SO4
Zn2+ + SO42- + 2Na+ + 2OH-  2Na+ + SO42- + Zn(OH)2
2Na+ + SO42- + Zn(OH)2 
Zn2+ + 2OH-  Zn(OH)2
Zn(OH)2 
5) Al(OH)3 + 3HNO3  Al(NO3)3 + 3H2O
Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ + 3NO3-  Al3+ + 3NO3- + 3H2O
Al3+ + 3NO3- + 3H2O
Al(OH)3 + 3H+  Al3+ + 3H2O
Al3+ + 3H2O
6) CaCO3 + 2HCl  CaCl2 + H2O + CO2
CaCl2 + H2O + CO2 
CaCO3 + 2H+ + 2Cl-  Ca2+ + 2Cl- + H2O + CO2
Ca2+ + 2Cl- + H2O + CO2 
CaCO3 + 2H+  Ca2+ + H2O + CO2
Ca2+ + H2O + CO2 
Задание 2. (слайд 13):
Полные и сокращенные ионные уравнения к заданиям 2,3,4,5 дети должны будут сделать дома)
Колдунья с вороном отравили лечебный колодец, в котором был раствор хлористого кальция, который помогал целому городу. Он использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl2 в нерастворимый известняк CaCO3. Помогите жителям “расколдовать” колодец, если в вашем распоряжении есть растворы NaCl, Na2CO3, HCl, H2SO4, Zn(NO3)2.
Проверка задания 2 (слайд 14):
СаСО3 + 2HCl  CaCl2 + H2O + CO2
CaCl2 + H2O + CO2 
Задание 3 (слайд 15):
Олененок спешит к друзьям. Он шел долгих 3 дня. Ему осталось только перейти реку, но река оказалась испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4, Ba(NO3)2.
Проверка задания 3 (слайд 16):
H2SO4 + Ba(OH)2  BaSO4
BaSO4  + 2H2O
+ 2H2O
Задание 4 (слайд 17)
Проверка задания 4 (слайд 18):
Cu(OH)2 + H2SO4  CuSO4 + 2H2O
CuSO4 + 2H2O
Задание 5 (слайд 19)
Проверка задания 5 (слайд 20):
BаСО3 + 2HCl  BaCl2 + H2O + CO2
BaCl2 + H2O + CO2 
Домашнее задание (слайд 21):Параграф 37... не забудьте составить полные и сокращенные ионные уравнения к заданиям 2, 3, 4, 5, решенным в классе, иначе Ваша помощь сказочным персонажам не будет полной.
Итак, сегодня мы познакомились с реакциями ионного обмена, теперь давайте подведем итог нашей работе. Заполните таблицу, лежащую у вас на столе.
| Я, понял что: | да | нет |
| 1.Реакции ионного обмена, это реакции в растворах электролитов |
|
|
| 2.Сфера реакции это область пространства, где проходит реакция |
|
|
| 3.Признаки протекания реакций ионного обмена: выпадение осадка, выделение газа, образование воды. |
|
|
| 4.Сокращенное ионное уравнение показывает какие ионы выделились из сферы реакции. |
|
|
| 5.Реакции между растворами кислоты и основания называются реакцией нейтрализации. |
|
|
V. Рефлексия
Рефлексия (каждый по фразе).
Продолжим фразу:
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
И все вместе:
| И отметим: |
| 1.На уроке я работал | активно / пассивно |
| 2.Своей работой на уроке я | доволен / не доволен |
| 3.Урок для меня показался | коротким / длинным |
| 4.За урок я | не устал / устал |
| 5.Мое настроение | стало лучше / стало хуже
|
| 6.Материал урока мне был | понятен / не понятен
полезен / бесполезен
интересен / скучен легким / трудным
|
| 7.Домашнее задание мне кажется | интересно / не интересно |
Итог урока: Выставление отметок.
Конкурс “Загадка”.
Одна команда загадывает какое-либо вещество, а другая должна отгадать его, задавая вопросы. Команда, которая загадала вещество, может ответить только “да” или “нет”.
| Команда “Атомы” - HCl | Команда “Молекулы” - NaOH |
| Это кислота? – да. | Это кислота? – нет. |
| Кислота кислородосодержащая? – нет | Это сильное основание? – да |
| Это сильная кислота? – да | Это основание растворимо в воде? – да |
| Кислота растворяется в воде? – да | Это основание двухосновное? – нет |
| Это одноосновная кислота? – да | В состав этого основания входит простой катион? - да |
| В этой кислоте сложный кислотный остаток? – нет | Это гидроксид натрия? – да |
| Это соляная кислота? - да | |
"Мозговая атака"
Вопросы классу:
Заведомо ложное умозаключение, построенное на неправильных положениях, называется софизмом. Попробуйте опровергнуть предложенные софизмы.
1. Все металлы проводят электрический ток, следовательно, все металлы - электролиты.
Ответ: Металлы в воде не растворяются, а электрический ток проводят, потому что в кристаллической решетке металлов есть свободные электроны - "свободный электронный газ". Электролиты проводят электрический ток, потому что в растворах или расплавах распадаются на ионы.
2. Если встать в лужу, в которой лежит оголенный провод, находящийся под напряжением, можно получить смертельный удар током. Следовательно, вода проводит электрический ток.
Ответ: Электрический ток проводит не вода, а соли, растворенные в воде. Дистиллированная вода электрический ток не проводит.
3. В дистиллированной воде приготовили настой лечебных плодов (шиповника, черники, калины). Настой стал проводить электрический ток. Почему?
Ответ: В плодах содержатся кислоты и соли, которые при растворении в воде диссоциируют на ионы, за счет которых настой проводит электрический ток.
4. При рентгеноскопии желудка пациенту дают выпить взвесь BaSO4. Объясните, почему чистый BaSO4 не вызывает отравлений, в то время как зафиксированы случаи со смертельным исходом при применении BaSO4 с примесями ВаСl2..
Ответ: Чистый BaSO4 не вызывает отравлений, так как это вещество, не растворимое в воде, а ВаСl2 хорошо растворим в воде и при диссоциации
ВаСl2 Ва2++2Сl- образует ионы Ва2+, которые являются ядом для организма человека.
Ва2++2Сl- образует ионы Ва2+, которые являются ядом для организма человека.
Задание для любознательных «Не дай себе засохнуть»
Изучить этикетки от бутылок с минеральной водой. На них записан состав воды в виде ионов. Составить формулы веществ и дать им название.







 aCl2+ H2SO4= BaSO4+2 HCl
aCl2+ H2SO4= BaSO4+2 HCl a2++2Cl-+2H++ SO42-= BaSO4+2H++2Cl- мы составили полное ионное уравнение, но это еще не все, теперь зачеркните формулы одинаковых ионов, сравнивая левую и правую часть уравнения.
a2++2Cl-+2H++ SO42-= BaSO4+2H++2Cl- мы составили полное ионное уравнение, но это еще не все, теперь зачеркните формулы одинаковых ионов, сравнивая левую и правую часть уравнения. a2++SO42-= BaSO4
a2++SO42-= BaSO4