Молекулярная физика.
Часть 1
Содержание.
Введение
1. Основные положения МКТ.
Тепловое движение молекул.
Броуновское движение.
Диффузия.
Частицы вещества.
Силы взаимодействия между молекулами.
2. Размеры и масса молекул. Основные итоги. Вопросы для самоконтроля
и повторения. Задачи для самостоятельного решения.
3. Скорость частиц вещества.
4. Идеальный газ. Основное уравнение МКТ.
Задачи для самостоятельного решения.
5. Температура. Абсолютная шкала температур
6. Уравнение состояния идеального газа.
Задачи для самостоятельного решения.
7. Газовые законы. Изопроцессы.
Таблица Д.И. Менделеева.
Ссылки
Введение.
Раздел физики, изучающий зависимости строения и физических свойств тел от характера движения и взаимодействия между частицами, из которых состоят тела, называется молекулярной физикой.
Молекулярная физика связана с термодинамикой и статистической физикой.
Существенный вклад в развитие молекулярно-кинетических представлений сделал М.В. Ломоносов. Он объяснил основные свойства газа, предположив, что все молекулы газа движутся беспорядочно, хаотично и при столкновениях отталкиваются друг от друга.
Беспорядочным движением молекул М.В. Ломоносов впервые объяснил природу теплоты. М.В. Ломоносов является основоположником молекулярно-кинетической теории строения вещества.
Теория, объясняющая свойства вещества на основе его молекулярного строения и непрерывного движения молекул, называется молекулярно-кинетической теорией (МКТ).
Основы молекулярно-кинетической теории.
1. Основные положения молекулярно-кинетической теории.
МКТ базируется на трех основных положениях:
Первое положение МКТ. Все вещества состоят из частиц - молекул, атомов или ионов.

 Рис. 1. Электронный микроскоп
Рис. 1. Электронный микроскоп
Электронные микроскопы позволяют видеть изображения отдельных атомов и молекул.
Основа строения вещества - атомы. Атомом называют наименьшую частицу данного химического элемента, сохраняющую его химические свойства. Атомы тоже имеют сложную структуру, они состоят из элементарных частиц-электронов, протонов, нейтронов. Атомы в целом электронейтральны. Атомы, имеющие избыток или недостаток электронов называются ионами. Бывают положительные и отрицательные ионы. Атомы могут объединяться в молекулы.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его химическими свойствами.
Второе положение МКТ.
Частицы вещества беспрерывно и беспорядочно движутся.
Беспорядочное (хаотичное) движение атомов и молекул в веществе называют тепловым движением, потому что скорость движения частиц увеличивается с ростом температуры. Экспериментальным подтверждением непрерывного движения атомов и молекул в веществе является броуновское движение и диффузия.
Броуновское движение.
Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Броуном (1827 г.) и явилось наглядным доказательством хаотичного молекулярного движения. Броуновские частицы движутся под влиянием ударов молекул. Из-за хаотичности теплового движения молекул, эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по величине и направлению, а ее траектория представляет собой сложную зигзагообразную линию. Молекулярно-кинетическая теория броуновского движения была создана А.Эйнштейном (1905 г.).
| 
Рис 2. Броуновская частица среди молекул | Рис. 2.  Рис.3.Траектория движения броуновской частицы |
Диффузия.
Явление самопроизвольного проникновения частиц одного вещества в промежутки между частицами другого вещества принято называть диффузией. При этом вещества перемешиваются (Рис. 4.). Почему же газы или жидкости перемешиваются, хотя их никто специально не перемешивает? Это можно объяснить, если вспомнить, что все вещества состоят из частиц, и между частицами есть промежутки. Раз газы или жидкости перемешиваются сами, значит, частицы


Рис. 4. Диффузия в жидкостях
вещества все время движутся, движутся беспорядочно, во всех направлениях. Это движение частиц и есть причина перемешивания двух веществ. Диффузией также называется процесс самопроизвольного выравнивания концентраций молекул жидкости или газа в различных частях объема. Скорость диффузии сильно зависит от длины свободного пробега молекул, то есть от среднего paccтoяния, которое пролетают молекулы между двумя последовательными соударениями с другими молекулами. Диффузия может происходить не только в газах, но и в жидкостях, и в твердых телах. Причем, диффузия газов происходит очень быстро, а диффузия твердых тел очень медленно. Опыты показывают: чем выше температура, тем диффузия происходит быстрее. Мы ощущаем запахи, благодаря диффузии пахучего вещества в воздухе.
Третье положение МКТ.
Частицы вещества взаимодействуют друг с другом.
Если бы между молекулами не существовало сил притяжения, то все тела при любых условиях находились бы только газообразном состоянии. Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров одной молекулы. Молекула - это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее, между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул (Рис. 5). Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими. На расстояниях, превышающих 2 - 3 диаметра молекул, действуют силы притяжения Рис. 6.). По мере уменьшения расстояния между молекулами сила притяжения сначала увеличивается, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул. При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться, и между молекулами возникают быстро нарастающие силы отталкивания.


Рис. 5. Взаимодействие электронов Рис.6. Зависимость силы взаимодействия
и атомных ядер молекул. от расстояния между молекулами
2. Размеры и масса молекул.
Свойства и поведение тел, в процессах передачи и превращения энергии, определяются движением взаимодействующих друг с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер этих частиц? Как его измерить? Если высыпать горошины из стакана на стол, то толщина образованного ими на столе слоя окажется равной диаметру горошины. Подобный способ можно использовать для определения размеров частиц вещества. Конечно же, реальная форма частиц вещества не шарообразная, а гораздо более сложная. Но указанный способ позволяет, с известной точностью, оценить размеры частиц вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).

Можно считать, что на каждую частицу вещества приходится объем, равный объему куба, сторона которого равна диаметру частицы. Тогда, зная плотность жидкости и диаметр частицы вещества, а стало быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера и массы молекулы сделаны ниже на рисунках 7 и 8 для капли нефти.


Рис. 7. Оценка размера молекулы.


Рис. 8. Оценка объёма и массы молекулы.

 В силу того, что массы частиц вещества крайне малы, удобно пользоваться не их абсолютными значениями (в килограммах), а относительными безразмерными величинами, называемыми относительной атомной массой и относительной молекулярной массой .
В силу того, что массы частиц вещества крайне малы, удобно пользоваться не их абсолютными значениями (в килограммах), а относительными безразмерными величинами, называемыми относительной атомной массой и относительной молекулярной массой .
В качестве атомной единицы массы (1 а.е.м.) принимается 1/12 массы изотопа углерода  ( ):
( ):



 1 а.е.м. = 1,66· 10-27 кг.
1 а.е.м. = 1,66· 10-27 кг.
Относительная молекулярная масса ( ) и относительная атомная массы ( ) равны:


О
Количество вещества - это отношение числа N молекул (атомов) в данном теле к числу атомов в 0,012 кг углерода:
динаковое число молекул разных веществ имеют разную массу. Принято сравнивать число молекул или атомов в данном веществе с числом атомов, содержащихся 0,012 кг углерода. Такое относительное число атомов или молекул характеризуется количеством вещества

.



В Международной системе СИ для измерения количества вещества  введена специальная единица - моль. 1 моль – это такое количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах изотопа углерода
введена специальная единица - моль. 1 моль – это такое количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах изотопа углерода  .
.
1 моль любого вещества содержит, по определению, одинаковое число молекул (атомов). Это число называют числом Авогадро:

Число молекул в  любого газа при нормальных условиях называется числом Лошмидта:
любого газа при нормальных условиях называется числом Лошмидта:

Масса 1 моля вещества называется молярной массой (М). Численное значение молярной массы, выраженной в г/моль, равно значению относительной атомной или молекулярной массы. Количество вещества, постоянная Авогадро, молярная масса, масса молекулы - эти величины связаны между собой соотношениями, которые приведены ниже на рисунках. Часто при решении той или иной задачи важнее знать не число частиц вещества, а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в единице объема (чаще всего - в одном кубическом метре) данного вещества. Ниже на рисунках приведены формулы для расчёта массы молекулы mo, молярной массы M, количества вещества v, числа молекул N и концентрации молекул n. (V - объем вещества).
Основные итоги.
Вопросы для самоконтроля и повторения.
1. Сформулируйте основные положения МКТ.
2. Что такое молекула?
3. Что такое атом?
4. Чем обусловлено броуновское движение?
5. Что такое диффузия?
6. Что принимается за 1 а.е.м.?
7. Что такое относительная молекулярная масса?
8. Что называется количеством вещества?
Единица измерения.
9. Каков физический смысл постоянной Авогадро?
10. Что показывает число Лошмидта?
11. Как найти массу одной молекулы?
12. Как найти число молей вещества?
Задачи для самостоятельного решения.
1. Найдите массу одной молекулы воды.
2. Определить массу атома железа и молекулы углекислого газа.
3. Сколько молекул газа находится в сосуде ёмкостью  при нормальных условиях?
при нормальных условиях?
4. Сколько молей молекул находиться в 100 г изделия из алюминия?
3. Скорость частиц вещества.
В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены скорости частиц вещества. Прибор Штерна состоял из двух цилиндров разных радиусов, закрепленных на одной оси (Рис. 9). Воздух из цилиндров был откачан до глубокого вакуума. Вдоль оси натягивалась платиновая нить, покрытая тонким слоем серебра. При пропускании по нити электрического тока она нагревалась до высокой температуры, и серебро с ее поверхности испарялось. В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проникали движущиеся атомы металла, осаждаясь на внутренней поверхности внешнего цилиндра, образуя хорошо наблюдаемую полоску (Рис.10 а). Цилиндры начинали вращать с постоянной угловой скоростью. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол (Рис.10 б). Зная величины радиусов цилиндров, скорость их вращения и величину смещения, легко найти скорость движения атомов. Если бы все атомы двигались с одинаковой скоростью, то при вращении установки полоска на стенке внешнего цилиндра получалась бы точно такой же тонкой, как и в случае, когда установка не вращалась. Однако при вращении полоска, образованная осевшими на стенку цилиндра атомами, оказывалась размытой (Рис.11). Значит, скорости атомов были разными:

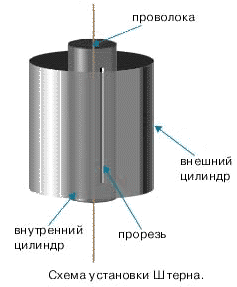


Рис. 9 Рис. 10 Рис.11
4. Идеальный газ. Основное уравнение МКТ.
Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель реальных газов - идеальный газ. Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически.
3. Молекулы взаимодействуют по законам упругих столкновений, силами притяжения
между молекулами пренебрегают.
4. Скорости молекул разноообразны, но при определённой температуре средняя скорость молекул остаётся постоянной.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа. Вследствие теплового движения, частицы газа время от времени ударяются о стенки сосуда (Рис. 12).


Рис.12 Рис. 13
При каждом ударе молекулы действуют на стенку сосуда с некоторой силой (Рис. 13). Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку. Понятно, что чем больше частиц содержится в сосуде, тем чаще они будут ударяться о стенку сосуда, и тем большей будет сила давления, а значит и давление. Чем быстрее движутся частицы, тем сильнее они ударяют в стенку сосуда. Чем больше масса частицы, тем больше сила удара. Чем быстрее движутся частицы, тем чаще они ударяются о стенки сосуда. Итак, сила, с которой молекулы действуют на стенку сосуда, прямо пропорциональна числу молекул, содержащихся в единице объема (это число называется концентрацией молекул и обозначается n), массе молекулы mo, среднему квадрату их скоростей (средней квадратичной скорости ( ) и площади стенки сосуда.
) и площади стенки сосуда.
В результате получаем:
давление газа прямо пропорционально массе частицы, концентрации частиц и средней квадратичной скорости частицы.
Зависимость давления идеального газа от концентрации и от средней кинетической энергии частиц выражается основным уравнением молекулярно-кинетической теории идеального газа: 
Мы получили основное уравнение МКТ идеального газа из общих соображений, но его можно строго вывести, опираясь на законы классической механики.
Связь давления газа со средней кинетической энергией молекул
Средняя кинетическая энергия поступательного движения молекулы:

Тогда давление идеального газа равно:

Таким образом: 
Связь давления с плотностью газа.
Так как  , то
, то 
Задачи для самостоятельного решения.
(Задачи даны в порядке по нарастающей сложности).
Задача 1. Как изменится давление водорода, находящегося в закрытом сосуде, если каждая молекула распадется на отдельные атомы, а средние квадраты скоростей не изменятся?
Задача 2. Имеются два одинаковых сосуда. В одном из них находится кислород, а в другом азот. Число молекул каждого газа и средние квадраты их скоростей одинаковы. Давление кислорода равно 32 кПа. Чему равно давление азота? Задача 3. В результате нагревания газа в закрытом сосуде средняя квадратичная скорость молекул увеличилась в 2 раза. Как изменилось давление? Задача 4. В сосуд, содержащий некоторое количество атомов гелия, добавляют такое же число молекул водорода, имеющих среднюю кинетическую энергию теплового движения, равную средней кинетической энергии теплового движения атомов гелия. Во сколько раз изменится давление в сосуде?
Задача 5. Рассчитайте силу удара молекулы газа о стенку сосуда, если она движется перпендикулярно стенке со скоростью u, масса молекулы mo, а время ее соударения со стенкой Δt.
Задача 6. Сколько ударов Z молекул о стенку площадью S=1 м2 происходит
за 1 с?
Задача 7 (проблемная). Спутник объемом V = 1000 м3 заполнен гелием. Метеорит пробил в стенке спутника отверстие площадью S = 1 см2. Оценить время, за которое давление упадет на 1%. Температуру внутри спутника считать неизменной. Средняя квадратичная скорость атомов гелия
v = 500 м/с.
5. Температура. Абсолютная шкала температур.
Молекулярно-кинетическая теория позволяет нам понять, что представляет собой физическая сущность такого сложного понятия, как температура. Когда соприкасаются два тела (или несколько тел), между ними происходит теплообмен. Если система тел изолирована (т.е. не взаимодействует с окружающими телами и внешней средой), теплообмен будет длиться до тех пор, пока температуры тел не выровняются, и не установится тепловое равновесие.
Тепловым или термодинамическим равновесием называют такое состояние, при котором все макроскопические параметры в системе сколь угодно долго остаются неизменными. Это означает, что в системе не меняются объем и давление, не изменяются агрегатные состояния вещества, концентрации веществ. Но микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях. В системе тел, находящейся в состоянии термодинамического равновесия, объемы и давления могут быть различными, а температуры обязательно одинаковы.
Таким образом, температура характеризует состояние термодинамического равновесия изолированной системы тел.
Для измерения температуры служат специальные приборы - термометры. Их действие основано на том факте, что при изменении температуры, изменяются и другие физические параметры тела, например, такие, как давление и объем.
В 1787 году Ж. Шарль из эксперимента установил прямую пропорциональную зависимость давления газа от температуры. Из опытов следовало, что при одинаковом нагревании давление любых газов изменяется одинаково.
Использование этого экспериментального факта легло в основу создания газового термометра. Если использовать температурную шкалу Цельсия, то экспериментально установленный Шарлем закон имеет вид:  , где
, где  - давление газа при температуре 0oС,
- давление газа при температуре 0oС,  - установленный из опытов температурный коэффициент давления газа. Можно преобразовать формулу, выражающую зависимость давления от температуры, используя абсолютную температурную шкалу (Т), предложенную Кельвином: р=T· const. (T=tº + 273 K). Измеряемая по шкале Цельсия температура может быть как положительной, так и отрицательной, в то время как абсолютная температура всегда неотрицательна. Наименьшая температура по абсолютной шкале - это абсолютный нуль. При такой температуре р=0, что согласно МКТ возможно, если средняя кинетическая энергия молекулы равна нулю.
- установленный из опытов температурный коэффициент давления газа. Можно преобразовать формулу, выражающую зависимость давления от температуры, используя абсолютную температурную шкалу (Т), предложенную Кельвином: р=T· const. (T=tº + 273 K). Измеряемая по шкале Цельсия температура может быть как положительной, так и отрицательной, в то время как абсолютная температура всегда неотрицательна. Наименьшая температура по абсолютной шкале - это абсолютный нуль. При такой температуре р=0, что согласно МКТ возможно, если средняя кинетическая энергия молекулы равна нулю.
Таким образом, при абсолютном нуле температуры прекращается тепловое движение частиц вещества. Ниже этой температуры быть уже не может. Эта температура приблизительно равна - 273oС. Единица абсолютной температуры называется кельвином (K).
 Рис. 14. Связь между абсолютной температурной
Рис. 14. Связь между абсолютной температурной
шкалой Кельвина и шкалой Цельсия
Опытным путем было установлено, что при постоянном объеме и температуре давление газа прямо пропорционально его концентрации. Объединяя экспериментально полученные зависимости давления от температуры и концентрации, получаем уравнение: р = nkT, где - k коэффициент пропорциональности - постоянная Больцмана:

Постоянная Больцмана связывает температуру со средней кинетической энергией движения молекул в веществе. Это одна из наиболее важных постоянных величин в МКТ.
Так как, с одной стороны,  , а с другой
, а с другой  , то
, то  ,
,
отсюда: 
Температура прямо пропорциональна средней кинетической энергии теплового движения частиц вещества. Следовательно, температуру можно назвать мерой средней кинетической энергии частиц, характеризующей интенсивность теплового движения молекул. Этот вывод хорошо согласуется с экспериментальными данными, показывающими увеличение скорости частиц вещества с ростом температуры.
Рассуждения, которые мы проводили для выяснения физической сущности температуры, относятся к идеальному газу. Однако выводы, полученные нами, справедливы не только для идеального газа, но и для реальных газов.
Справедливы они и для жидкостей и твердых тел. В любом состоянии температура вещества характеризует интенсивность теплового движения его частиц.
6. Уравнение состояния идеального газа.
Молекулярно-кинетическая теория рассматривает идеальный газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр.
Такие параметры называются микроскопическими или микропараметрами:

Однако состояние газов можно охарактеризовать немногим числом физических величин, относящимся не к каждой молекуле, а ко всему газу в целом. Такие параметры называются макроскопическими или макропараметрами. Если состояние газа не меняется, то не меняются и эти параметры.
Поэтому температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа.
Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния р, V и Т. Если исключить из уравнения МКТ микроскопический параметр - число частиц, - заменив его с помощью известных соотношений макроскопическим параметром - массой, то можно получить другую форму записи уравнения состояния:


Уравнение состояния идеального Уравнение состояния идеального
газа - уравнение Клапейрона газа - уравнение Менделеева-Клапейрона
Задачи для самостоятельного решения.
1. Газ при давлении 0,2 МПа и температуре 15oС имеет объем 5 л. Чему равен объем
газа этой массы при нормальных условиях?
2. При температуре 27oС давление газа в закрытом сосуде было 75 кПа. Каким будет
давление этого газа при температуре -13oС?
7. Газовые законы. Изопроцессы.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров - давление, объем или температура - остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа. Изотермический процесс - процесс изменения состояния системы при постоянной температуре.
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это газовый закон Бойля - Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с большой внешней системой - термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему:

Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы (Рис.15). Разным температурам соответствуют разные изотермы.



Рис.15. Изотермы в координатах рV, VT и pT.
Изохорный процесс - процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля.
Согласно закону Шарля, давление газа прямо пропорционально его температуре:

Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры (Рис.16). Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.



Рис.16. Изохоры в координатах рТ, рV и VT.
Изобарный процесс - процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это газовый закон Гей-Люссака.
Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре:

Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары (Рис.17).



Рис.17. Изобары в координатах VТ, рV и pT.
Закон Гей-Люссака, как и закон Шарля, не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов. Законы Бойля - Мариотта, Гей-Люссака и Шарля называют частными газовыми законами. Они являются частными случаями объединенного газового закона:
отношение произведения давления газа и объема к температуре для данной массы газа - величина постоянная:

 Рис. 18. Вывод частных уравнений газовых
Рис. 18. Вывод частных уравнений газовых
законов из объединённого газового закона
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов (Рис. 19). Парциальное давление - это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.

Рис. 19. Закон Дальтона
Периодическая таблица элементов Д.И. Менделеева
| Период\ Группа | I | II | III | IV | V | VI | VII | VIII |
| I | 1 H
1.0079 водород | | 2 He
4.0026 гелий |
| II | 3 Li
6.941 литий | 4 Be
9.0122 бериллий | 5 B
10.811 бор | 6 С
12.011 углерод | 7 N
14.007 азот | 8 О
15.999 кислород | 9 F
18.998 фтор | 10 Ne
20.180 неон |
| III | 11 Na
22.990 натрий | 12 Mg
24.305 магний | 13 Al
26.982 алюминий | 14 Si
28.086 кремний | 15 P
30.974 фосфор | 16 S
32.066 сера | 17 Cl
35.453 хлор | 18 Ar
39.948 аргон |
| IV | 19 K
39.098 калий | 20 Ca
40.078 кальций | 21 Sc
44.956 скандий | 22 Ti
47.88 титан | 23 V
50.942 ванадий | 24 Cr
51.996 хром | 25 Mn
54.938 марганец | 26 Fe
55.847 железо | 27 Co
58.933 кобальт | 28 Ni
58.69 никель |
| 29 Cu
63.546 медь | 30 Zn
65.39 цинк | 31 Ga
69.723 галлий | 32 Ge
72.61 германий | 33 As
74.922 мышьяк | 34 Se
78.96 селен | 35 Br
79.904 бром | 36 Kr
83.80 криптон |
| V | 37 Rb
85.468 рубидий | 38 Sr
87.62 стронций | 39 Y
88.906 иттрий | 40 Zr
91.224 цирконий | 41 Nb
92.906 ниобий | 42 Mo
95.94 молибден | 43 Tc
[98] технеций | 44 Ru
101.07 рутений | 45 Rh
102.91 родий | 46 Pd
105.42 палладий |
| 47 Ag
107.87 серебро | 48 Cd
112.41 кадмий | 49 In
114.82 индий | 50 Sn
118.71 олово | 51 Sb
121.75 сурьма | 52 Te
127.60 теллур | 53 I
126.90 иод | 54 Xe
131.29 ксенон |
| VI | 55 Cs
132.91 цезий | 56 Ba
137.33 барий | 57 La
138.91* лантан | 72 Hf
178.49 гафний | 73 Ta
180.95 тантал | 74 W
183.85 вольфрам | 75 Re
186.21 рений | 76 Os
190.2 осмий | 77 Ir
192.22 иридий | 78 Pt
195.08 платина |
| 79 Au
196.97 золото | 80 Hg
200.59 ртуть | 81 Tl
204.38 талий | 82 Pb
207.2 свинец | 83 Bi
208.98 висмут | 84 Po
[209] полоний | 85 At
[210] астат | 86 Rn
[222] радон |
| VII | 87 Fr
[223] франций | 88 Ra
226.03 радий | 89 Ac
227.03** актиний | 104 Rf
[261] резерфордий | 105 Db
[262] дубний | 106 Sg seaborgium | 107 Bh борий | 108 Hs hassium | 109 Mt meitnerium | 110 Ds Darmstadtium |
| 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 |
| * Лантаноиды |
| 58 Ce
140.12 церий | 59 Pr
140.91 празеодим | 60 Nd
144.24 неодим | 61 Pm
[145] прометий | 62 Sm
150.36 самарий | 63 Eu
151.97 европий | 64 Gd
157.25 гадолиний | 65 Tb
158.93 тербий | 66 Dy
162.50 диспрозий | 67 Ho
164.93 гольмий | 68 Er
167.26 эрбий | 69 Tm
168.93 тулий | 70 Yb
173.04 иттербий | 71 Lu
174.97 лютеций |
| ** Актиноиды |
| 90 Th
232.04 торий | 91 Pa
231.04 протактиний | 92 U
238.03 уран | 93 Np
237.05 нептуний | 94 Pu
[244] плутоний | 95 Am
[243] америций | 96 Cm
[247] кюрий | 97 Bk
[247] берклий | 98 Cf
[251] калифорний | 99 Es
[252] эйнштейний | 100 Fm
[257] фермий | 101 Md
[258] менделеевий | 102 No
[259] нобелий | 103 Lr
[262] лоуренсий |
Ссылки
Ресурсы по физике.
1. Львовский М.Б. Физика в школе.
2. Молекулярная физика. Тепловые явления.
3. Физикон, МФТИ (СD-ROM «Открытая физика», ч.1 и 2).
4. Открытый колледж. Проект Физикона.
5. Кривченко И.В. Сайт Физика. ру.
Интернет-ресурсы
(по дистанционному образованию).
Центр Информатизации Министерства образования РФ.
Центр дистанционного образования "Эйдос".
Кафедра физики МИОО
Рисунки по молекулярной физике
Рисунки по физике. Молекулярная физика
1C репетитор. Физика. (Есть одноименный CD-ROM).
Справочник по физике. Молекулярная физика
Молекулярная физика и термодинамика курса общей физики
Евроазиатская ассоциация дистанционного образования.
Проект "Гармония".







 Рис. 1. Электронный микроскоп
Рис. 1. Электронный микроскоп


















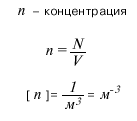




 Рис. 14. Связь между абсолютной температурной
Рис. 14. Связь между абсолютной температурной 











 Рис. 18. Вывод частных уравнений газовых
Рис. 18. Вывод частных уравнений газовых 










