Контрольная работа №1
Тема: «Строение вещества»
1 вариант
1. Определите число протонов, нейтронов и электронов у атома хрома. Составьте его электронную и электронно-графическую формулы.
Определите степени окисления элементов в веществах, формулы которых:
NaCl, SO3 , H2 , Cu, KNO3, CO2 . Определите типы химической связи атомов в этих соединениях.
Решите задачу. К 27,6г карбоната калия добавили 315г азотной кислоты.
Вычислите, какой объем оксида углерода (IV) (н.у.) при этом образуется.
Решите задачу. Определите массу соли и массу воды, которые
потребуются для приготовления раствора объемом 120 мл (плотность 1,1г/мл) с массовой долей соли 15%.
2 вариант
1. Определите число протонов, нейтронов и электронов у атома цинка. Составьте его электронную и электронно-графическую формулы.
Определите степени окисления элементов в веществах, формулы которых:
NH3 , Fe, NaOH , Cl2 , HF, NO2. Определите типы химической связи атомов в этих соединениях.
Решите задачу. Вычислите объем водорода (н.у.), который может
выделиться при взаимодействии 1,2г магния с 10г серной кислоты.
Решите задачу. Вычислите массу гидроксида калия в растворе объемом
600 мл и плотностью 1,082г/мл, если массовая доля KOH составляет 10%.
Критерии оценивания: правильно выполненные два задания – оценка «3», три задания – оценка «4», все задания без ошибок – оценка «5».
Контрольная работа № 2
Тема: «Химические реакции»
1 вариант
Определите тип реакции:
а) Zn + 2НCl Н2 + ZnCl2
б) CaO + H2O = Ca(OH)2 + Q
Закончите уравнения реакций. Запишите их в полном, ионном и
сокращенном ионном виде:
а) MgCO3 + HNO3 =
б) NaOH + FeCl3 =
Температурный коэффициент реакции равен 2. На сколько градусов нужно
повысить температуру, чтобы скорость реакции возросла в 16 раз?
Как сместить равновесие в сторону прямой реакции:
а) 2SO2(г) + O2 2SO3(г) + Q
б) 2 C2H2 + 5O2 4 CO2 + 2 H2O+ Q
в) C4H10 C4H8 + H2 – Q.
5. Рассчитайте количество теплоты, выделившееся при сжигании 10г железа по уравнению: 3Fe + 2O2 Fe3O4 + 1116 кДж.
2 вариант
Определите тип реакции:
а) С(тв) + СО2 2СО - Q
б) 2KMnO4 = K2MnO4 + O2 + MnO2
Закончите уравнения реакций. Запишите их в полном, ионном и сокращенном ионном виде:
а) H3 PO4 + NaOH =
б) BaCO3 + HCl =
Определите, во сколько раз увеличилась скорость реакции при повышении
температуры с 50 до 80 оС, если температурный коэффициент реакции равен 3.
Как сместить равновесие в сторону прямой реакции:
а) 2NО(г) +Cl2 2NOCl (г) + Q
б) 2 CО(г) + 5O2 2CO2(г) + Q
в) C2H4(г) C2H2(г) + H2 (г) – Q.
Рассчитайте количество теплоты, выделившееся при сжигании 1кг угля, если
тепловой эффект химической реакции 393,5 кДж.
Критерии оценивания: правильно выполненные три задания – оценка «3», четыре задания – оценка «4», все задания без ошибок – оценка «5».
Контрольная работа №3
Тема: «Вещества и их свойства»
1 вариант
1.Определите класс каждого из веществ, формулы которых HCl, Fe(OH)3, CO, H2CO3, CuO, AlCl3, и дайте их названия.
2. Используя метод электронного баланса, составьте уравнения реакций. Определите окислитель и восстановитель.
Zn + H2SO4 = ZnSO4 + H2S + H2O
3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
S 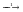 SO2
SO2 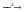 SO3
SO3 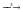 Na2SO4
Na2SO4 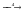 BaSO4
BaSO4
4. Решите задачу. При разложении 20 г карбоната кальция получено 10 г оксида кальция. Какова массовая доля выхода продукта от теоретически возможного (в %)?
2 вариант
1.Определите класс каждого из веществ, формулы которых Ca(OH)2, HNO3, P2O5, CaCO3, H2O, H2SO4, и дайте их названия.
2. Используя метод электронного баланса, составьте уравнения реакций. Определите окислитель и восстановитель.
FeS + HNO3 → Fe(NO3)2 + S + NO + H2O
3. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Zn 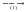 ZnO
ZnO 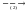 ZnCl2
ZnCl2 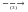 Zn(OH)2
Zn(OH)2 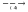 ZnSO4
ZnSO4
4. Решите задачу. Карбонат натрия массой 212г обработали раствором азотной кислоты, при этом получили 185,6 г нитрата натрия. Вычислите массовую долю выхода селитры от теоретически возможного(в %).
Критерии оценивания: правильно выполненные два задания – оценка «3», три задания – оценка «4», все задания без ошибок – оценка «5».





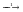 SO2
SO2 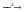 SO3
SO3 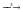 Na2SO4
Na2SO4 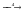 BaSO4
BaSO4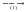 ZnO
ZnO 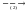 ZnCl2
ZnCl2 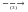 Zn(OH)2
Zn(OH)2 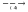 ZnSO4
ZnSO4









