Промежуточная аттестация
Итоговая контрольная работа по курсу химии средней школы
профильный уровень
Вариант 1
Время выполнения работы – 90 минут
Часть 1. Задания с выбором правильного ответа и на соотнесение.
1. Электронная конфигурация 1s22s22p63s23p6 соответствует частице:
а) N-3 б) Cl- в) S+4 г) Na+
2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса:
а) Be, B, C, N в) O, S, Se, Te
б) Rb, K, Na, Li г) Mg, Al, Si, P
3. Окислительная способность неметаллов в ряду: кремний - углерод - азот — кислород
а) возрастает в) сначала возрастает, а затем убывает б) убывает г) сначала убывает, а затем возрастает.
4. Одинаковую степень окисления железо проявляет в соединениях:
а) FeO и FeCO3 в) Fe2O3 и Fe(NO3)2
б) Fe(OH)3 и FeCl2 г) FeO и FePO4
5. В ряду водородных соединений неметаллов РНз - H2S - НСl:
а) не наблюдается проявление кислотно-основных свойств
б) основные свойства усиливаются, кислотные убывают
в) кислотно-основной характер соединений не изменяется
г) основные свойства убывают, кислотные усиливаются.
6. Кислотные свойства увеличиваются в ряду веществ:
а) HF, НС1, HBr в) Н2SO4, HNO3, H2CO3
б) Н2S, HI, HF г) Н2SO3, НС1, Н2CO3
7. В каком из рядов расположены только солеобразующие оксиды;
а) СО2, SO2, N2O, SO3 в) NO, As2O5, Br2O5, SO2
б) СО, С12О7, Р2О3, SO3 г) СО2, С12О7, Р2О5, SeO3
8. Амфотерным гидроксидом является:
а) гидроксид железа(II) в) гидроксид меди (I)
б) гидроксид хрома (III) г) гидроксид хрома (VI)
9. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) фосфорной кислотой и водородом в) кислородом и оксидом серы(IV)
б) сульфатом калия и гидроксидом натрия г) водой и гидроксидом кальция
10. В каком из рядов представлены вещества, с которыми способна взаимодействовать серная
кислота (раствор):
а) магний, оксид железа(II), гидроксид натрия, сульфит натрия
б) ртуть, гидроксид натрия, сульфат натрия, оксид меди(II)
в) гидроксид алюминия, сера, оксид железа(II), карбонат кальция
г) оксид меди(II), гидроксид цинка, оксид углерода(IV), сульфит натрия.
11. Образование осадка происходит при взаимодействии:
а) нитрата меди (II) и серной кислоты в) сульфата железа (III) и хлорида бария
б) карбоната кальция и нитрата натрия г) азотной кислоты и фосфата алюминия
12. Окислительно-восстановительной является реакция, уравнение которой:
а) СаСО3 + SiO2 �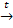 � CaSiO3 + CO2 в) CuCl2 + Fe → FeCl2 + Cu
� CaSiO3 + CO2 в) CuCl2 + Fe → FeCl2 + Cu
б) BaSO3 �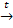 � BaO + SO2 г) CuSO4 + 2KOH → Cu(OH)2 + K2SO4
� BaO + SO2 г) CuSO4 + 2KOH → Cu(OH)2 + K2SO4
13. В схеме превращений FeCl3 → Х1 → Х2 → Fe(OH)3 веществами Х1 и Х2 являются: а) Fe2(SO4)3 и Fe2O3 в) Fe(NO3)2 и Fe2O3
б) FePO4 и Fe3O4 г) Fe(OH)3 и Fe2(SO4)3
14. Установите соответствие между формулой иона и его способностью проявлять окислительно-восстановительные свойства.
ФОРМУЛА ИОНА ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
а) S2- 1) только окислитель
б) NO3- 2) только восстановитель
в) NO2- 3) и окислитель, и восстановитель
г) C+4 4) ни окислитель, ни восстановитель
15. Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
а) AICI3 + 3NaOH→ 1) AgCI, AI(NO3)3
б) AICI3 + NaOHизбыток→ 2) не взаимодействуют
в) AICI3 + AgNO3избыток→ 3) AgCI, AI(NO3)2СI
г) AICI3 + Н2SO4раствор→ 4) Na[AI(OH)4], NaCI
5) AI2(SO4)3, HCI
6) AI(OH)3, NaCI
16. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА ВЕЩЕСТВА
а) оксид кремния (IV) 1) AI, HNO3, CО
б) оксид азота (IV) 2) C, KOH, CaCO3
в) оксид бария 3) HNO3, Ca(OH)2, H2O
г) оксид железа(III) 4) NaOH, CаО, Н2О
5) Fe, CO2, H2O
6) H2O, SO3, H3РO4
17. Установите соответствие между металлом и способом его электролитического получения:
МЕТАЛЛ ЭЛЕКТРОЛИЗ
а) натрий 1) водного раствора солей б) алюминий 2) водного раствора гидроксида в) серебро 3) расплава хлорида
г) медь 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) расплавленного нитрата
18. Установите соответствие между составом соли и типом ее гидролиза: СОСТАВ СОЛИ ГИДРОЛИЗ
а) BeSO3 1) по катиону
б) KNO2 2) по аниону
в) Pb(NO3)2 3) по катиону и аниону
г) СuCl2
Часть 2. Задания с развернутым ответом.
1. Задача. Из раствора массой 350 г с массовой долей соли 25 % выпариванием удалили 100 г воды. Определите массовую долю растворённого вещества в полученном растворе.
2. Осуществите цепочку химических превращений органических веществ.
+H2O +Na t, кат. +О2, Pd
Метилат калия ⎯→ X1 ⎯→ Бромметан ⎯→ Х2 ⎯→ Х3 ⎯⎯→ Этаналь.
3. Задача. Рассчитайте, какой объем 10% раствора хлороводорода плотностью 1,05г/мл пойдет на полную нейтрализацию гидроксида кальция, образовавшегося при гидролизе карбида кальция, если выделившийся при гидролизе газ занял объем 8,96л (н.у.).
4. Задача. При сгорании 17,5 г органического вещества получили 28 л (н. у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н. у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта. На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
Критерии оценки:
Часть 1: за каждое задание 1-13 – 1 балл
14- 18 - 2 балла
Часть 2:
Задание 1- 1 балл
Задание 2 – 5 баллов
Задание 3- 4 балла
Задание 4 – 3 балла
Общее количество - 36 баллов
Шкала перевода процента выполнения тестовых заданий в отметки.
Выполнено правильно 91% - 100% - оценка «5» (33-36 балла);
Выполнено правильно 74% - 90% - оценка «4» (27-32 баллов);
Выполнено правильно 50% - 73% - оценка «3» (19-26 баллов);
Выполнено правильно 0% - 49% - оценка «2» (0- 18 баллов).
Промежуточная аттестация
Итоговая контрольная работа по курсу химии средней школы
профильный уровень
Вариант 2
Время выполнения работы – 90 минут
Часть 1. Задания с выбором правильного ответа и на соотнесение.
1. Электронная конфигурация 1s22s22p63s23p6 соответствует частице:
а) Li+ б) К+ в) Cs+ г) Na+
2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса:
а) Be, B, C, N в) O, S, Se, Te
б) Rb, K, Na, Li г) Mg, Al, Si, P
3. В ряду водородных соединений неметаллов РНз - H2S - НСl:
а) не наблюдается проявление кислотно-основных свойств
б) основные свойства усиливаются, кислотные убывают
в) кислотно-основной характер соединений не изменяется
г) основные свойства убывают, кислотные усиливаются.
4. Восстановительная способность неметаллов в ряду: кремний - углерод - азот – кислород
а) возрастает в) убывает б) сначала возрастает, а затем убывает г) сначала убывает, а затем возрастает.
5. Одинаковую степень окисления фосфор проявляет в соединениях:
а) Са3Р2 и Н3РО3 в) Р4O6 и Р4O10
б) КН2РО4 и КРО3 г) Н3РО4 и Н3РО3
6. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса:
а) Na, Mg, Al, Si в) P, S, Cl, Ar б) Li, Be, B, C г) F, O, N, C
7. Амфотерным гидроксидом является:
а) гидроксид цинка в) гидроксид хрома (VI)
б) гидроксид хрома (II) г) гидроксид меди (II)
8. Кислотными оксидами являются:
a) NO2, Сг2О3, А12О3, SiO2 в) СО2, N2O3, SeO3, C12O7 б) СО, Мп2О7, К2О, Р2О5 г) ZnO, C12O7, Fe2O3, SO2
9. Вещество, при диссоциации которого образуются катионы Na+, H+, а также анионы �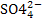 �, является:
�, является:
а) кислотой в) средней солью
б) щелочью г) кислой солью
10. Окислительно -восстановительной не является реакция, уравнение которой:
а) 2Na + Cl2 → 2NaCl в) Zn + 2HCl → ZnCl2 + H2
б) 2NaCl + Н2SO4 → Na2SO4 + 2NaCl г) N2 + 3H2 → 2NH3
11. Гидроксид цинка реагирует с каждым из веществ:
а) сульфат кальция и оксид серы(IV) в) вода и хлорид натрия б) гидроксид натрия (р-р) и соляная кислота г) сульфат бария и гидроксид железа (III)
12. В каком из рядов представлены вещества, с которыми способна взаимодействовать соляная
кислота:
а) цинк, оксид меди(П), гидроксид натрия, сульфит натрия
б) медь, сульфат натрия, оксид меди(П), гидроксид натрия
в) оксид железа(П), гидроксид алюминия, карбонат кальция, сера
г) оксид углерода(IV), оксид меди(II), гидроксид цинка, сульфит натрия.
13. В схеме превращений ZnO → Х1 → Х2 → Zn(OH)2 веществами Х1 и Х2 являются: а) ZnCl2 и ZnSO4 в) Zn(OH)2 и ZnCl2
б) Zn(OH)2 и ZnSO4 г) ZnCl2 и ZnO
14. Установите соответствие между схемой химической реакции и изменением степени окисления восстановителя:
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ
а) FeCl3 + HI → FeCl2 + I2 + НС1 1) Fe+3 → Fe+2
б) FeCl2 + Cl2 → FeCl3 2) 2I- → �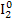 �
�
в) KClO4 → KCl + O2 3) 2O-2 → �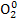 �
�
г) Fe3O4 + HI → FeI2 + I2 + H2O 4) Fe+2 → Fe+3
5) Cl+7 → Cl-
6) ��Cl0 → 2Cl-
15. Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
а) KOH + SO3 → 1) KHSO4
б) KOH(избыток) + SO3 → 2) K2SO3
в) KOH + СО2 (избыток) → 3) K2CO3 и H2O
г) KOH(избыток) + СО2 → 4) K2SO4 и H2O
5) KHCO3
6) KHSO3
16. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА ФОРМУЛЫ РЕАГЕНТОВ
а) Н2S 1) НNO3, I2, CuS
б) НNO3р-р 2) SO2, Ca(OH)2, Cr2O3
в) Н2SO4р-р 3) Ba(NO3)2, H2O, Cu
г) HCI 4) Ba(NO3)2, Zn, BaCO3
5) O2, CrO3, H2SiO3
6) FeS, F2, AgNO3
17. Установите соответствие между названием вещества и способом его получения: НАЗВАНИЕ ВЕЩЕСТВА ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
а) литий 1) раствора LiF
б) фтор 2) расплава LiF
в) серебро 3) раствора MgCl2
г) магний 4) раствора AgNO3
5) расплава Ag2O
6) расплава MgCl2
18. Установите соответствие между составом соли и типом ее гидролиза: СОСТАВ СОЛИ ГИДРОЛИЗ
а) Cr2S3 1) по катиону
б) AlCl3 2) по аниону
в) K2SO4 3) по катиону и аниону
г) Na3PO4 4) не гидролизуется
Часть 2. Задания с развернутым ответом.
1. Задача. В воде растворили гидроксид калия массой 11,2 г, объём раствора довели до 200 мл. Рассчитайте молярную концентрацию полученного раствора.
2. Осуществите цепочку химических превращений органических веществ.
+HCl + Н2SO4(к)
Глюкоза ⎯→ Х1 ⎯→ Х2 ⎯→ этилбензол ⎯→ Х3 ⎯→ Изопропилбензоат.
3. Задача. Карбид кальция обработан избытком воды. Выделившийся газ занял объем 4,48 л (н.у.). Рассчитайте, какой объем 20% соляной кислоты, плотностью 1,1 г/мл, пойдет на полную нейтрализацию щелочи, образовавшейся из карбида кальция.
4. Задача. При сгорании некоторого органического вещества массой 1,85 г получили 1,68 л углекислого газа (н. у.) и 1,35 г воды. Известно, что при гидролизе исходного соединения образуется вещество, вступающее в реакцию «серебряного зеркала».
На основании данных условия задачи:
1) произведите вычисления, необходимые для нахождения формулы исходного органического вещества;
2) установите его молекулярную формулу;
3) составьте структурную формулу этого вещества, которая отражает порядок связей атомов в молекуле;
4) напишите уравнение реакции гидролиза этого вещества в присутствии серной кислоты.
Критерии оценки:
Часть 1: за каждое задание 1-13 – 1 балл
14- 18 - 2 балла
Часть 2:
Задание 1- 1 балл
Задание 2 – 5 баллов
Задание 3- 4 балла
Задание 4 – 3 балла
Общее количество - 36 баллов
Шкала перевода процента выполнения тестовых заданий в отметки.
Выполнено правильно 92% - 100% - оценка «5» (33-36 балла);
Выполнено правильно 75% - 91% - оценка «4» (27-32 баллов);
Выполнено правильно 51% - 74% - оценка «3» (19-26 баллов);
Выполнено правильно 0% - 50% - оценка «2» (0- 18 баллов).








 СН3 – СН2 – СОН Х1 Х2 Х3 Х4
СН3 – СН2 – СОН Х1 Х2 Х3 Х4 











