Повышенный 11 класс
КОНТРОЛЬНАЯ РАБОТА 5
НЕМЕТАЛЛЫ: ВОДОРОД, НЕМЕТАЛЛЫ V—VII ГРУПП
 ВАРИАНТ 1
ВАРИАНТ 1
ЗАДАНИЕ 1
1. Укажите правильное утверждение относительно азота и фосфора:
А. находится в больших периодах периодической системы
Б. электроотрицательность азота выше, чем фосфора
В. максимальная валентность равна IV
Г. общая формула высшего оксида- Э2О3
2. Наименьшее значение степени окисления атомы фосфора имеют в соединении:
А. H3PO4 Б. Ca3P2 В.P2O3 Г.P2O5
ЗАДАНИЕ 2
3. Число атомов кислорода, равное 14,448 ・ 1023, содержится в сернистом газе объемом (н. у., дм3):
1) 26,88; 2) 33,60; 3) 35,84; 4) 44,80; 5) 47,04.
4. Кислород и озон:
а) имеют одинаковый качественный и количественный состав;
б) хорошо растворимы в воде (20 °С);
в) обладают одинаковой химической активностью;
г) реагируют с некоторыми металлами, стоящими в ряду активности после водорода;
д) существуют в природе.
1) а, б; 2) б, в, г; 3) г, д; 4) а, г, д; 5) б, в.
5. Выберите утверждения, характеризующие водород как химический ЭЛЕМЕНТ:
а) атомы в молекуле связаны ковалентной неполярной связью;
б) в реакции с натрием образуется вещество с ионной связью;
в) входит в состав глюкозы;
г) существует в виде трех изотопов;
д) самый легкий газ (н. у.).
1) а, б, д; 2) б, в, д; 3) в, г; 4) б, д; 5) а, в, г.
6. Окислением простого вещества кислородом НЕвозможно получить оксид:
1) Cl2O7; 2) CO; 3) NO; 4) Fe3O4; 5) CuO.
ЗАДАНИЕ 3
7. Дана схема превращений, в которой каждая реакция обозначена буквой (А – Г):
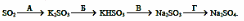
Для осуществления превращений выберите четыре реагента из предложенных:
1 – NaBr; 2 – SO2 (водн); 3 – K2SO4; 4 – KOH; 5 – NaOH; 6 – MgSO4.
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв, например: А3Б1В5Г2.
8. Для восполнения недостатка азота у растений в почву в качестве азотного удобрения требуется внести аммиачную селитру массой 40 кг. Рассчитайте массу (кг) карбамида, которым можно заменить указанную массу аммиачной селитры.
ЗАДАНИЕ 4
9. Смешали раствор, содержащий серную кислоту количеством 0,2 моль, и раствор, содержащий гидроксид калия массой 16,8 г. Объем образовавшегося раствора равен 1000 см3. Учитывая, что все растворенные вещества диссоциируют полностью, определите pH полученного раствора.
10. Укажите молярную массу (г/моль) вещества Д в цепочке превращений, если вещество Г в реакционной среде находится в избытке: НАПИШИТЕ СХЕМЫ УРАВНЕНИЙ РЕАКЦИЙ
SiO2+C,t Ca,t HCl O2 Ca3(PO4)2




 Ca3(PO4)2 A Б B Г Д
Ca3(PO4)2 A Б B Г Д
ЗАДАНИЕ 5
11. Смесь оксида серы (IV) и кислорода пропустили над катализатором при нагревании. Врезультате этого объемная доля этого оксида в газовой смеси снизилась с 40% до 20%. Вычислите объемную долю % оксида серы (VI) в полученной газовой смеси
12. В основе работы свинцового аккумулятора лежит реакция: Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O.
Сухой аккумулятор заправили раствором серной кислоты массой 2 кг. В ходе разрядки аккумулятора массовая доля кислоты в растворе снизилась с 31 % до 25 %. Определите массу (г) серной кислоты в конечном растворе.







 ВАРИАНТ 1
ВАРИАНТ 1
 ВАРИАНТ 1
ВАРИАНТ 1