Контрольная работа к главе “Химические реакции”
Часть A
А1. Даны уравнения трех реакций:
PCL3 + CL2 = PCL5;
2KI + Br2 = 2RBr + I2;
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Для реакции замещения рассчитайте суммарную массу продуктов, образующихся при взаимодействии исходных веществ массой по 10 г каждое:
а) 20,0г; б)15,6г; в)14,8г; г)19,2г.
А2. В окислительно-восстановительной реакции, схема которой
KCLO3 + FeSO4 + H2SO4 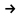 Fe2(SO4)3 + KCL + H2O,
Fe2(SO4)3 + KCL + H2O,
Сумма коэффициентов перед окислителем и восстановителем равна:
а) 4; б) 7; в) 9; г) 10.
А3. Дана цепочка превращений:
Ca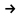 Ca(OH)2
Ca(OH)2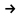 CaO
CaO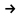 CaCO3
CaCO3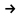 CaO.
CaO.
Из четырех приведенных реакций:
а) большинство экзотермических;
б) большинство эндотермических;
в) эндотермических реакций нет;
г) число экзотермических и эндотемических реакций одинаково.
А4. Количество тепловой энергии, которое выделяется или поглощается в ходе химической реакции, называется:
А) тепловым эффектом;
Б) энергией активации;
В) теплотой образования;
Г) температурным коэффициентом.
А5. При добавлении к избытку воды 5,6 г оксида кальция выделяется 6,4 кДж теплоты, а при реакции 14 г оксида кальция с водой можно получить 3,8 ккал теплоты. Укажите соотношение между этими двумя единицами измерения энергии:
а) 1 кал = 1 Дж; б) 1 Дж  4,2 кал;
4,2 кал;
в) 1 Дж  0,42 кал; г) 1 кал
0,42 кал; г) 1 кал  4,2 Дж.
4,2 Дж.
А6. На графике изображено изменение концентрации продукта некоторой реакции с течением времени. В какой из равных временных промежутков средняя скорость реакции максимальна?
а) t1 – t2; б) t2 – t3;
в) t3 – t4; г) t4 – t5.
А7. Физический смысл температурного коэффициента Вант-Гоффа заключается в том, что он показывает:
А) скорость химической реакции при увеличении температуры на 10 оС;
Б) во сколько раз увеличивается скорость химической реакции при увеличении температуры на 2-4 оС;
В) во сколько раз увеличивается скорость химической реакции при увеличении температуры на каждые 10 оС;
Г) на сколько градусов необходимо увеличить температуру реакции, чтобы ее скорость увеличилась в 2-4 раза.
А8. В промышленности гидрирование жидких жиров проводят с использованием катализатора:
а) серебра; б) меди;
б) платины; г) никеля.
А9. Дегидрирование алканов является эндотермическим процессом. Какое из воздействий будет способствовать смещению равновесия в реакции:
CH3 – CH2 – CH2 – CH3(r) 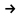 CH2= CH – CH = CH2(r) + 2H2(r)
CH2= CH – CH = CH2(r) + 2H2(r)
в сторону образования бутадиена-1 ,3?
А)уменьшение температуры;
Б) уменьшение давления;
В) увеличение концентрации водорода;
Г) внесение катализатора.
А10. Увеличение температуры приводит к смещению равновесия в реакции синтеза аммиака в сторону исходных веществ:
N2 + 3H2 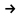 2NH3 + Q.
2NH3 + Q.
Почему в промышленности этот процесс ведут при повышенной температуре?
А) прямая реакция экзотермична , смесь газов нагревается, и ее охлаждение требует значительных материальных затрат;
Б) значительно сокращается время достижения равновесия;
В) аммиак получается более высокого качества;
Г) все приведенные выше причины верны.
А11. Долю молекул, распавшихся на ионы в растворе, показывает величина:
А) константы диссоциации;
Б) степени диссоциации;
в) температурного коэффициента;
г) верного ответа среди перечисленных нет.
А12. Краткому ионному уравнению
CH3COO- + H+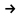 CH3COOH
CH3COOH
соответствует взаимодействие между:
а) ацетатом магния и водой;
б) ацетатом аммония и гидроксидом натрия;
в) ацетатом натрия и кремниевой кислотой;
г) ацетатом калия и азотной кислотой.
А13. Ионы какой группы могут быть легко удалены из раствора в виде труднорастворимых соединений?
а) Cu2+ , CO32- , NO3- ; б)Fe3+ , Na+ , Cl-;
б) Ca2+ , S2- , SiO32- ; г) Pb2+ , NH4+ , Br-.
А14. В каком случае растворы трех солей в группе можно распознать с помощью универсальной индикаторной бумаги?
а) KCl, HCOONa, Al2(SO4)3;
б) NH4NO3, Na2SO4, BaCl2;
в) Pb(NO3)2, K2SO4, NH4Br;
г) K2S, NaCN, MgSO4.
А15. В водном растворе какой соли концентрация ионов водорода будет наибольшей?
а) SnCl2; б) Ca(NO3)2; в) C6H5OK; г) Na2CO3.
В1. Дана цепочка превращений:
C2H2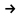 C6H6
C6H6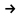 C6H5NO2
C6H5NO2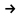 C6H5NH2
C6H5NH2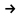 [C6H5NH3]+Cl-.
[C6H5NH3]+Cl-.
Напишите название вещества, полученного по реакции замещения.
В2. На скорость гомогенной газофазной реакции оказывают влияние природа реагирующих веществ, давление (и, следовательно, концентрация веществ), присутствие катализатора. Какой важный фактор не назван?
В3. Реакция синтеза аммиака, уравнение которой
N2(r) + 3H2(r) 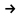 2NH3(r),
2NH3(r),
достигла состояния равновесия. Напишите название вещества, удаление которого из смеси газов приведет к смещению равновесия вправо.
В4. Как называются вещества, водные растворы которых проводят электрический ток (напишите термин во множественном числе)?
В5. Приведены названия десяти неорганических и органических веществ: иодид калия, нитрат железа(III), сульфит натрия, сульфат аммония, хлорид серебра, сахароза, этаналь, олеат натрия, этилацетат, глицерин. Сколько из них способны гидролизоваться? (Число в ответе напишите словом)
Часть С
С1. Допишите левые части уравнений химических реакций. Расставьте коэффициенты.
а) … 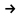 CaCO3 + 2NaCl;
CaCO3 + 2NaCl;
б) …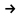 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O;
Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O;
в) …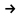 CH3 – C
CH3 – C + CH3COOH;
+ CH3COOH;
г) … 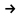 CH3-CH-CH-CH3 + NaBr.
CH3-CH-CH-CH3 + NaBr.
| |
CH3 CH3
С2. Для реакции, уравнение которой
CH3OH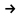 H – C
H – C + H2-Q.
+ H2-Q.
напишите выражение константы равновесия. Укажите все известные вам способы смещения равновесия в сторону образования метаналья.







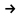 Fe2(SO4)3 + KCL + H2O,
Fe2(SO4)3 + KCL + H2O, 4,2 кал;
4,2 кал; + CH3COOH;
+ CH3COOH; + H2-Q.
+ H2-Q.









