Входная контрольная работа
А1. Число атомов всех химических элементов в молекуле серной кислоты равно:
А2. Элемент второго периода главной подгруппы III группы ПСХЭ - это:
| 1) литий | 3) кальций |
| 2) бор | 4) магний |
А3. Число протонов, нейтронов и электронов в атоме фтора 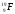
| 1) p+ – 9; n0 – 10; ē – 19 | 3) p+ – 9; n0 – 10; ē - 9 |
| 2) p+ – 10; n0 – 9; ē – 10 | 4) p+ – 9; n0 – 9; ē - 19 |
А4. Группа формул веществ с ковалентным типом связи:
| 1) H2S, P4, CO2 | 3) HCl, NaCl, H2O |
| 2) H2, Na, CuO | 4) CaO, SO2, CH4 |
А5. Верны ли следующие высказывания?
А. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
| 1) верно только А | 3) верно только Б |
| 2) верны оба суждения | 4) оба суждения не верны |
А6. Запись 3О2 означает:
| 1) 2 молекулы кислорода | 3) 5 атомов кислорода |
| 2) 3 молекулы кислорода | 4) 6 атомов кислорода |
А7. Физическое явление - это:
| 1) испарение воды | 3) горение керосина |
| 2) скисание молока | 4) появление ржавчины |
А8. Формула сульфата железа (III):
| 1) FeS | 3) Fe2 (SO4)3 |
| 2) FeSO4 | 4) Fe2(SO3)3
|
В1. Установите соответствие между формулой вещества и классом соединения:
| Формула вещества: | Класс соединения: |
| А) Н3РО4 | 1) соль |
| Б) SO3 | 2) основный оксид |
| В) Сu(OH)2 | 3) нерастворимое основание |
| Г) CaCl2 | 4) кислотный оксид |
|
| 5) кислота |
|
| 6) растворимое основание |
В2. С раствором гидроксида натрия реагируют:
| 1) сульфат меди (II) | 4) азотная кислота |
| 2) оксид меди (II) | 5) магний |
| 3) гидроксид калия | 6) оксид углерода (IV) |
Ответ: _____________
C1. Используя метод электронного баланса, составьте уравнение реакции:
HNO3 = H2O + NO2 + O2.
Определите окислитель и восстановитель.
Назовите все сложные вещества, укажите тип реакции.
C2. По уравнению реакции Fe(OH)2 = FeO + H2O определите массу оксида железа (II), образовавшегося при разложении 45 г исходного вещества.
Контрольная работа №1 по теме «Теория электролитической диссоциации»
1. Электрический ток проводит:
1) водный раствор спирта;
2) водный раствор глюкозы;
3) расплав сахара;
4) расплав хлорида натрия.
2. С образованием катионов металла и анионов кислотного остатка диссоциирует
1) сахароза
2) гидроксид натрия
3) бромид алюминия
4) азотная кислота
3.К анионам относится каждая из двух частиц:
1) OH- , H+ 2) Na+, H+ 3) SO4 2- ,F- 4) O2 , N2
4. Взаимодействию раствора гидроксида натрия с серной кислотой соответствует сокращенное ионное уравнение:
Na++ SO4 2-→ Na2SO4 3) Na++ OH- → NaОН
H+ +OH-→ H2O 4) H++ NaОН → H2O + Na+
5. Реакция ионного обмена не идет между растворами электролитов
1) гидроксид натрия и соляная кислота
2) серная кислота и нитрат натрия
3) соляная кислота и карбонат натрия
4) сульфат медиII и гидроксид натрия
6.При полной диссоциации 1 моль фосфата натрия в растворе образуется
3 моль катионов натрия и 4 моль фосфат-ионов
2 моль катионов натрия и 3 моль фосфат-ионов
1 моль катионов натрия и 3 моль фосфат-ионов
3 моль катионов натрия и 1 моль фосфат-ионов
7. Вещество, при диссоциации которого образуется сульфит-ион
1) K2 S 2) K2 SO4 3) K2 SO3 4) KH SO4
8. В уравнении реакции Аg + H2SO4 =Ag2SO4 + SO2+ H2O окислителем является
1) Аg 2) H2SO4 3) SO2 4) H2O
В1. Для качественного определения ионов, находящихся в растворе сульфата меди(II), можно использовать:
1) фенолфталеин
2) раствор хлорида бария
3) раствор нитрата калия
4) раствор гидроксида натрия
5) оксид алюминия
В2. Установите соответствие
Электролит Продукты диссоциации Пример
1. Кислота 1. Катионы металла + анионы кислотных остатков 1. NaOH↔Na++ OH-
2. Щелочи 2. Катионы водорода + анионы кислотных остатков 2. KCl↔K++ Cl-
3. Соли 3. Катионы металла + анионы гидроксогрупп 3. HNO3↔H++NO3-
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: SO2 — SO3 — X — BaSO4
С2. 750 мл воды растворили в 10г нитрата кальция. Вычислите массовую долю соли в растворе (в %)
Контрольная работа №2 по теме « Подгруппа кислорода»
А1. Два электронных слоя и шесть электронов во внешнем слое имеют атомы химического элемента, название которого
1) кремний; 2) азот; 3) кислород; 4) сера.
А2.В ряду элементов O→S→Se→Te
возрастает число электронных слоёв в атомах;
усиливаются металлические свойства;
возрастает число электронов внешнего слоя в атомах;
уменьшается степень окисления в их оксидах.
А3. .Ряд чисел 2,8,8 соответствует распределению электронов по электронным слоям в частице
1)S0 2) S-2 3) S+4 4) S+6
А4 Процессу окисления соответствует схема превращения
S+4 — S+6 2) S0 — S-2 3) S+6 — S-2 4) О0— О-2
А5. Химическое равновесие в системе H2S(г) ↔ H2(г) + S(г) – Q сместится в сторону продуктов реакции при
1) повышении давления 2) повышении температуры
3) понижении давления 4) использовании катализатора
А6. Щелочную среду имеет раствор соли:
1) ) NaCl 2) ZnCl2 3) FeSO4 4) Na2S
А7. Оксид серы (IV) взаимодействует с :
Оксидом фосфора(V) 2)нитратом калия 3) хлороводородом 4) гидроксидом натрия
А8. При комнатной температуре кислород взаимодействует с:
1) азотом 2) серой 3) натрием 4) водородом
В1. Установите соответствие между уравнением химической реакции и смещением химического равновесия при увеличении давления в системе.
Уравнение реакции Направление смещения химического равновесия
А. 2HI(г) ↔ H2(г) + I2(тв) 1. Смещается в сторону прямой реакции
Б. C(г) + 2S(г) ↔ CS2(г) 2. Смещается в сторону обратной реакции
В. C3H6(г) + H2(г) ↔ C3H8(г) 3. Не происходит смещения равновесия
Г. H2(г) + F2(г) ↔ 2HF(г)
В2. Установите соответствие между исходными веществами и продуктами реакции.
| Исходные вещества | Продукты реакции |
| А) SO2 + H2O — . | 1) H2SO4. |
| Б) SO3 + NaOH — . | 2) H2SO3. |
| В) H2SO4 + Na2O — . | 3) SO3 + H2. |
|
| 4) Na2SO4 + H2O. |
|
| 5) Na2SO4 + H2. |
С1. H2 S— X1 — SO3 — X2 — Na2 SO4
С2. При взаимодействии 37г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака от теоретически возможного.
Контрольная работа №3 по теме «Подгруппа азота и углерода. Галогены»
А.1У элементов подгруппы азота с увеличением атомного номера уменьшается:
1) атомный радиус 3) число валентных электронов в атомах
2) заряд ядра атома 4) электроотрицательность
А2. В атоме фосфора общее число электронов и число электронных слоев соответственно равны: 1) 31 и 4 2) 15 и5 3) 15 и 3 4) 31 и 5
А3. Сумма протонов и нейтронов в атоме углерода равны:
1) 14 2) 12 3) 15 4) 13
А4. Ковалентная полярная химическая связь характерна для:
1) KCl 2) HBr 3) P4 4) CaCl2
А5. Степень окисления азота в нитрате кальция равно:
-5 2) -3 3) +5 4) +3
А6. Иону С1─ соответствует схема заполнения электронных слоев
1) 2; 8; 7 2) 2; 8; 8 3) 2; 8 4) 2; 8; 5
А7. Для того, чтобы доказать, что в пробирке находится раствор угольной кислоты,
необходимо использовать: 1) соляную кислоту 3) тлеющую лучинку
2) раствор аммиака 4) раствор гидроксида натрия
А8. Признаком реакции между соляной кислотой и цинком является:
1) появление запаха 3) выделение газа
2) образование осадка 4) изменение цвета раствора
В1. Установите соответствие между схемой химической реакции и изменением степени окисления в ней
Схема реакции Изменение степени окисления окислителя
А) Cu + HNO3→ Cu(NO3)2 + NO2 + H2O 1) N+3 →N0
Б) NH4NO2 →N2+H2O 2) N+5→ N+4
В ) CuO + NH3→ Cu + N2 + H2O 3) N-3→ N0
Г) NaNO3 →NaNO2 + O2 4)N+5→ N+3
В2. Установите соответствие между исходными веществами и продуктами реакции.
исходные вещества продукты реакции
А) КВr + I2→ 1) HC1 + HC1O
Б) С12 + Н2О → 2) HC1 + S
В) С12 + Н2S→ 3) Br2 + KI
Г) НС1 + CuO→ 4) не взаимодействуют
5) CuCl2 + Н2О
С1.Составьте молекулярные уравнения реакций следующих превращений:
C → CO2 → Na2CO3 → CaCO3
С2. При обработке 300 г древесной золы избытком соляной кислоты, получили 44,8л(н.у.) углекислого газа. Какова массовая доля (%) карбоната калия в исходном образце золы?
Контрольная работа №4 по теме «Металлы»
А 1. Электронная формула атома лития:
А. 1S2 2S2. Б. 1S2 2S1. B. 1S2 2S2 2p1. Г. 1S2 2S2 2p6 3S1.
А 2. Электронная формула внешнего энергетического уровня атомов щелочных металлов:
А. ns1. Б. ns2. В. ns2 np1. Г. ns2 np2.
А3. Вид химической связи в простом веществе натрий:
А. Ионная Б. Ковалентная полярная
В. Ковалентная неполярная Г. Металлическая
А4. Простое вещество с наиболее ярко выраженными металлическими
свойствами:
А. Алюминий. Б. Бор. В. Галлий. Г. Индий.
А5. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается.
А6. Атом кальция отличается от иона кальция:
А. Зарядом ядра. В. Числом протонов. Г. Числом нейтронов.
Б. Числом электронов на внешнем энергетическом уровне.
А7. . Наиболее энергично реагирует с водой:
А. Барий. Б. Кальций. В. Магний. Г. Стронций.
А8. С соляной кислотой не взаимодействует:
А. Алюминий. Б. Магний. В. Серебро. Г. Цинк.
В1. Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества Продукты реакции
А) Ca(OH)2 + SO3 1) CuSO4 + H2O
Б) Ca(OH)2 + H2SO4 2) CaSO4 + H2O
В) H2S + Ba(OH)2 3) CaSO3 + H2O
4) Ba(HS)2 + H2O
5) CuSO4 +H2
В2. Установите соответствие.
Схема реакции: Продукты реакции:
1) Li + O2 → а) → Fe3O4 + H2;
2) Hg + O2 → б) → реакция не идет;
3) Fe + H2O → в) → Li2O;
г) → HgO;
д) → LiOH + H2;
е) → Fe3O4
С1.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe→ FeO→FeCl2 →Fe (OH)2 →FeO
C2. Какая масса серебра может быть вытеснена медью из раствора нитрата серебра массой 340г. с массовой долей соли 2%
Годовая контрольная работа
А1.Основным оксидом является
1) оксид брома (VII)
2) оксид натрия
3) оксид серы (IV)
4) оксид алюминия
А2. Электрический ток проводит
водный раствор глюкозы
водный раствор хлорида натрия
3) расплав серы
4) расплав оксида кремния
А3. Практически необратимо протекает реакция ионного обмена между растворами
1) хлорида калия и нитрата меди (II)
2) серной кислоты и хлорида бария
3) сульфата натрия и гидроксида калия
4) нитрата натрия и хлорида железа (III)
А5. . Какое из указанных веществ имеет ковалентную полярную связь
1) NaCl 2) H2S 3) H2 4) CaCl2
А6. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху необходимо наклониться над сосудом и глубоко
вдохнуть.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А7 В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
NH3 и PCl3
NH3 и Ca3P2
NO2 и P2O5
NO2 и P2O3
А8. В реакцию с разбавленной серной кислотой вступает
1) медь 2) вода 3) оксид углерода (IV) 4) оксид натрия
В1. В ряду химических элементов Si – P – S
уменьшается число протонов в ядре
уменьшается электроотрицательность
увеличивается число электронов во внешнем электронном слое
увеличивается радиус атомов
усиливаются неметаллические свойства
В2. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
 А) SO2 + H2O 1) H2SO4
А) SO2 + H2O 1) H2SO4
 Б) SO3 + NaOH 2) H2SO3
Б) SO3 + NaOH 2) H2SO3
 В) H2SO4 + Na2O 3) SO3 + H2
В) H2SO4 + Na2O 3) SO3 + H2
4) Na2SO4 + H2O
5) Na2SO4 + H2
С1Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:


 AlCl3 X Al2O3 NaAlO2
AlCl3 X Al2O3 NaAlO2
С2 К 27 г раствора с массовой долей хлорида меди (II) 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка







 А) SO2 + H2O 1) H2SO4
А) SO2 + H2O 1) H2SO4

 AlCl3 X Al2O3 NaAlO2
AlCl3 X Al2O3 NaAlO2









