МДК.03.01 Очистка и контроль качества природных и сточных вод
Тема: Определение физических показателей воды
Цель: определение органолептических и санитарно-токсикологических показателей качества воды
Формирование знаний/умений/формируемых компетенций:
Знать: гигиенические требования к качеству питьевой воды и санитарные нормы очищенным сточным водам и водам водоёмов различного назначения; методы и параметры контроля природных и сточных вод. Технологические процессы забора воды из поверхностных и подземных источников уметь: выполнять химические и микробиологические анализы по контролю технологических процессов и качества очистки природных и сточных вод; выполнять контроль за соблюдением экологических стандартов и нормативов по охране окружающей среды; Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач
ПК 3.1; ПК 3.2; ПК 3.3; ОК 01 – ОК 10;
Основная часть
Нормирование качества воды заключается в установлении для воды водного объекта совокупности допустимых значений показателей ее состава и свойств, в пределах которых надежно обеспечиваются здоровье населения, благоприятные условия водопользования и экологическое благополучие водного объекта. Гигиеническими требованиями к охране поверхностных вод, введенных в действие с 1.03.91 г., предусмотрены общие требования к составу и свойствам воды водоемов, предназначенной для хозяйственно-питьевого, коммунально-бытового и рыбохозяйственного назначения. К хозяйственно-питьевому водопользованию относится использование водных объектов в качестве источника хозяйственно-питьевого водоснабжения, а также для водоснабжения предприятий пищевой промышленности. К коммунально-бытовому относится использование объектов для купания, занятия спортом и отдыха населения. К рыбохозяйственному водопользованию относится использование водных объектов для обитания, размножения и миграции рыб и других водных организмов. Рыбохозяйственные водные объекты делятся на три категории: высшая (места нерестилищ, массового нагула и зимовальных ям особо ценных и ценных видов рыб); первая (водные объекты для воспроизводства ценных видов, обладающих высокой чувствительностью к кислороду); вторая (водные объекты, используемые для других рыбохозяйственных целей). Для всех видов водопользователей регламентируются в первую очередь физические показатели качества воды. Под физическими свойствами воды понимают ее органолептические свойства (запах, вкус, цвет, прозрачность), а также температуру, плотность, вязкость и т.п. Запах воды может быть как естественного (травянистый, болотный, древесный и т.п.), так и искусственного происхождения из-за загрязнения воды стоками предприятий. При качественной оценке запаха определяется его характер. Характер запаха оценивается словесно (травянистый, землистый, древесный, гнилостный, затухлый, сернистый, хлорный, углеводородный и т.д.). Количественная оценка интенсивности запаха дается в баллах по пятибалльной шкале (табл. 1). Согласно существующим нормам интенсивность запаха воды при 20 0С не должна превышать 2 баллов.
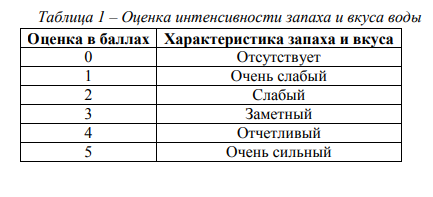
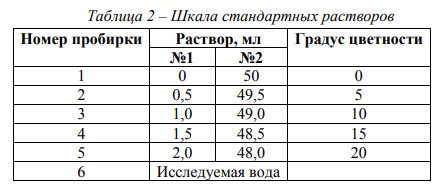
Вкус воды обуславливается присутствием в ней веществ природного происхождения или веществ, которые попадают со сточными водами, а также продуктов жизнедеятельности организмов. При качественной оценке вкуса воды используются четыре вида вкусовых ощущений: горький, сладкий, кислый, соленый. Количественная интенсивность вкуса оценивается по пятибалльной шкале (см. табл. 1). Интенсивность вкуса питьевой воды не должна превышать 2 балла. Цветность воды зависит от наличия в ней растворенных и взвешенных примесей (коллоидных соединений железа, гуминовых веществ, взвешенных и окрашенных веществ, водорослей). В зависимости от количества гуминовых кислот и их солей (гуматов) цвет колеблется от желтого до коричневого. Цветность воды определяют качественно и количественно. Результаты качественного исследования цветности воды описывают словесно (бесцветная, светло-желтая, бурая и т.п.). Количественно цвет воды определяют путем сравнения исследуемой воды со шкалой стандартных растворов и выражают в условных градусах этой шкалы (табл. 2). При отсутствии окраски вода считается бесцветной.
Прозрачность воды обусловлена ее цветом и мутностью, т.е. зависит от количества содержащихся в воде взвешенных веществ (частицы песка, глины, почвы и т.п.). Определяют прозрачность воды непосредственно в водоеме или в пробах для анализа. Результаты качественного определения прозрачности воды путем сравнения с эталоном из дистиллированной воды оценивают словесно (слабо мутная, очень мутная и др.). Количественная оценка прозрачности воды проводится по кресту или шрифту. Прозрачность по кресту устанавливается в водоеме или при контроле качества очистки воды на очистных сооружениях путем нахождения предельной высоты 9 столба воды, через которую просматривается черный крест на белом фоне. Питьевая вода должна иметь прозрачность по кресту не менее 30 см. Определение прозрачности по шрифту в лабораторных условиях основано на нахождении максимальной высоты столба воды в бесцветном цилиндре, через который можно прочитать стандартный шрифт. Прозрачность питьевой воды по шрифту должна быть не менее 30 см. Температура и плотность – общеизвестные параметры воды. Плотность чистой воды зависит от ее температуры и составляет при 15 оС 0,99913 г/см3 , при 20 оС – 0,99823 г/см3 . Плотность природных и сточных вод зависит также и от растворенных соединений. Обычно плотность воды близка к единице. В этой работе необходимо определить основные физико- химические показатели качества исследуемой воды. Все результаты опытов должны быть занесены в табл. 3. После выполнения всех исследований сравнить полученные показатели с установленными нормативами (предельно допустимыми концентрациями) и сделать вывод о качестве исследуемой воды.
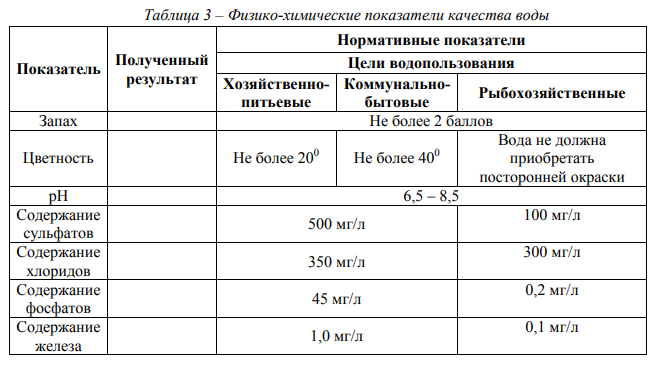
Опыт 1. Исследование запаха воды Материалы и оборудование: колбы с пробкой ёмкостью 200 см3 , пробы воды. Ход работы: в колбу с притертой пробкой емкостью 200 см3 налить исследуемую воду до 2/3 объема и сильно встряхнуть вращательным движением в закрытом состоянии. Затем открыть и сразу же определить обонянием характер и интенсивность запаха. Дать оценку характера и интенсивности запаха по пятибалльной шкале (см. табл. 1). Результаты исследований запаха воды представить в виде табл. 4, а также занести в табл. 3.

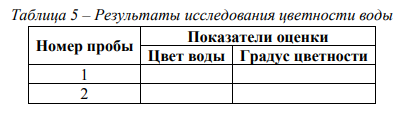
Опыт 2. Исследование цветности воды Материалы и оборудование: бесцветные цилиндры емкостью 200 см3 диаметром 30 мм, цилиндры емкостью 10 см3 , плотные фильтры, градуированная пипетка, мерный стакан, концентрированная серная кислота, основной раствор №1, вспомогательный раствор № 2 или компоненты для их приготовления (бихромат калия K2Cr2O7 и сульфат кобальта CoSO4∙7H2O), дистиллированная вода, пробы воды. Ход работы: Для качественной оценки цветности воды отфильтровать через бумажный фильтр не менее 40 – 50 см3 исследуемой воды. Профильтрованную воду налить в бесцветный цилиндр и сравнить с таким же объемом дистиллированной воды в другом таком же цилиндре. Анализ выполняется на фоне белого листа бумаги при дневном освещении. Воду рассматривают сверху и сбоку и указывают наблюдаемый цвет (бесцветная, светло-желтая, бурая и т.д.). Количественно цветность воды определяется по хромато-кобальтовой шкале. Шкала цветности готовится путем смешения раствора №1 (основной) и №2 (вспомогательный). Для приготовления раствора №1 необходимо в небольшом объеме дистиллированной воды растворить в отдельной посуде 0,0875 г бихромата калия (K2Cr2O7) и 2,0 г сульфата кобальта (CoSO4∙7H2O). Растворы солей смешать, прибавить 1 см3 концентрированной серной кислоты и довести дистиллированной водой до 1 дм3 . Раствор №2 содержит 1 см3 концентрированной серной кислоты в 1 дм3 дистиллированной воды (раствор серной кислоты). Шкала цветности готовится в пяти цилиндрах по 50 см3 путем смешения растворов №1 и №2 в соотношении согласно табл. 2. Для определения цветности в пробирку (цилиндр) №6, однотипную с теми, в которых приготовлена шкала, налить 50 см3 исследуемой воды. Сравнить окраску воды с окраской растворов в пяти цилиндрах на белом фоне, отыскивая место в шкале, тождественное или максимально приближенное по окраске. Цветность выражают в градусах цветности по данным табл. 2. Результаты исследований цветности воды представить в виде табл. 5, а также занести в табл. 3.
Опыт 3.Определение pH воды. Материалы и оборудование: невысокий стеклянный бюкс объёмом 20 см3 , набор универсальной индикаторной бумаги, шкала универсального индикатора. Ход работы: В стеклянный бюкс налить исследуемую воду, погрузить в воду полоску универсальной индикаторной бумаги и быстро сравнить полученный цвет бумаги со стандартной шкалой универсального индикатора. Результат занести в табл. 6 и 3.

Опыт 4. Определение содержания хлоридов Материалы и оборудование: стеклянные пробирки объёмом 10 см3 , раствор нитрата серебра 10%, раствор азотной кислоты 2Н, мерный цилиндр объёмом 25 см3 . Ход работы: в пробирку налить 5 см3 воды и добавить 3 – 4 капли 10%-ного раствора нитрата серебра. Появление осадка или мути указывает на присутствие в воде хлоридов. По табл. 7 провести полуколичественное определение хлоридов. Для того чтобы убедиться, что осадок образовался за счет хлорид - ионов, в пробирку добавить несколько капель азотной кислоты. Нерастворившийся осадок или муть свидетельствует о содержании в воде именно хлоридов. Результаты определения занести в табл. 3

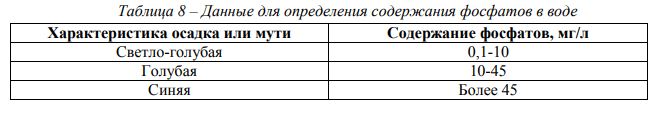
Опыт 5. Определение содержания фосфатов Материалы и оборудование: химический стакан объёмом 100 см3 , мерный цилиндр объёмом 100 см3 , раствор соляной кислоты (1:5), раствор молибдата аммония, раствор хлорида олова, мерные пипетки объёмом 5 см3 . Ход работы: В химический стакан объёмом 100 см3 налить 50 см3 пробы воды, добавить 1 см3 соляной кислоты (1:5), 1 см3 раствора молибдата аммония и по каплям ввести раствор хлорида олова (всего 3 капли). По интенсивности окраски полученного раствора судят о количестве фосфат-ионов в исследуемой воде (табл. 8). Результаты испытаний занести в табл. 3.
Опыт 6. Определение содержания катионов железа Материалы и оборудование: стеклянные пробирки объёмом 10 см3 , мерные пипетки объёмом 10 см3 , мерные колбы объёмом 50 см3 , раствор серной кислоты 1Н, раствор сульфосалициловой кислоты 10%, стандартная шкала для определения содержания катионов железа в воде. Ход работы: для определения содержания в воде солей железа налить 10 см3 исследуемой воды в мерную колбу, добавить 1 см3 серной кислоты (для создания кислой среды). Далее прибавить 5 см3 10%-ного раствора сульфосалициловой кислоты. Раствор долить до метки дистиллированной водой и перемешать. Для сравнения с растворами стандартной шкалы приготовленный раствор налить в пробирку до уровня, одинакового со стандартными растворами. Окраску сравнивать, рассматривая растворы сверху. В присутствии ионов железа раствор окрашивается в розовый цвет. По стандартной шкале (табл. 9) определить содержание в воде катионов железа.

Содержание катионов железа в пробе воды считать равным тому значению, которое соответствует стандартному раствору шкалы с окраской раствора, наиболее близкой окраске пробы. Результаты занести в табл. 3.
Сделать вывод, для каких целей, возможно, использовать исследуемую воду.
Список учебной литературы:
1. Белецкий Б. Ф. Технология и механизация строительного производства: Учебник для ВПО. Изд. 3-е. Ростов н/Д: Феникс, 2004. — 752 с.
https://www.studmed.ru/beleckiy-bf-tehnologiya-i-mehanizaciya-stroitelnogo-proizvodstva-djvuraspoznannyy_7d87537b560.html
2. Белецкий Б. Ф. Технология и механизация строительного производства: Учебник для ВПО. - М: Издательство АСВ, 2001. — 416 с.
https://mgsu.ru/universityabout/Struktura/Instituti/ISA/metodobesp/tosp/literatura/Белецкий%20Учебник%20ТСП%5Bsmallpdf.com%5D.pdf
3. Феофанов, 10. Л. Современные материалы и изделия для ремонта и строительства инженерных сетей / Ю. А. Феофанов, А. В. Жуховицкий. — СПб.: Изд-во СПбГАСУ, 2018.
4. Храменков, С. В. Бестраншейные методы восстановления трубопроводов / С. В. Храменков, О. Г. Примин, В. А.Орлов. — М.: Прима-Пресс-М, 2019.
5. https://rusneb.ru/
6. https://www.elibrary.ru/defaultx.asp





































