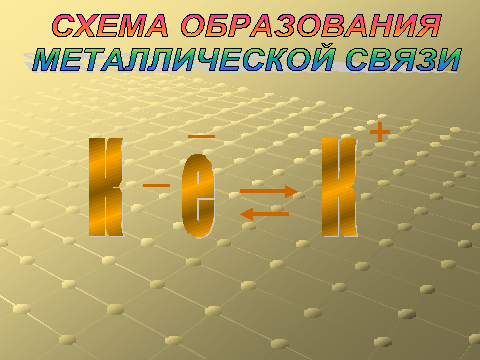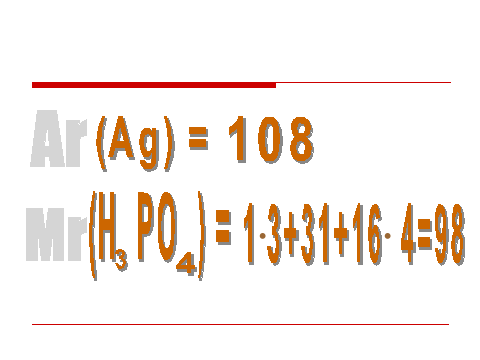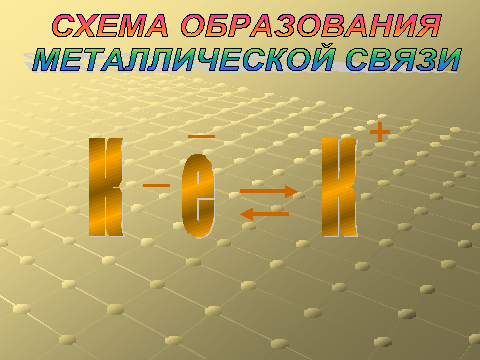Тема: Атомы химических элементов
Тип урока: Обобщающий.
Вид урока: Урок - презентация
Цели урока: Обобщить знания учащихся по теме, проверить степень усвоения материала;
стимулировать познавательную активность, развивать интерес к предмету, мыслительные операции по систематизации знаний, умение быстро и четко формулировать свои мысли, логически рассуждать, применять свои знания на практике.
Оборудование: Периодическая система химических элементов Д. И. Менделеева (настенная таблица, раздаточный материал на столы учащихся), схемы слайдов, компьютер, диапроектор, экран.
Пояснительная записка к уроку.
В настоящее время учителя составляют краткие конспекты к изучаемым темам или разделам. Эта работа помогает
осмыслить большой фактический материал;
выделить главные, существенные моменты темы;
дать основные определения.
При обобщении темы необходимо осмыслить большое количество вопросов.
Как организовать урок, чтобы не тратить много времени на записи у доски, чтобы урок был наглядный, доступный, активизировал внимание учащихся.
С этой целью использую на уроках компьютерные презентации. Конечно много времени уходит на разработку презентации. Учителю необходимо выделить основные аспекты темы, вопросы и компактно расположить материал на слайдах. Продумать каждый шаг урока – вопросы учителя, предположить ответ ученика, появление отдельных символов на слайде (до или после ответа ученика).
Преимущества разработки уроков-презентаций в том, что отдельные слайды можно использовать при изучении каждого раздела.
ХОД УРОКА.
I. Тема урока.
Учитель начинает урок словами И. В. Гете (на экране на первом слайде)
Трудности возрастают по мере приближения к цели. Но пусть каждый совершит свой путь подобно звездам, спокойно, не торопясь, но беспрерывно стремясь к намеченной цели.
Знакомит учащихся с целью и задачами урока.
Задачи урока:
1. Закрепить понятия:
2. Систематизировать, обобщить, закрепить знания:
3. Закрепить умение:
определять координаты элемента в ПСХЭ;
составлять схему строения атома и иона;
выражать состав атома;
записывать схему образования соединений с различным видом связи
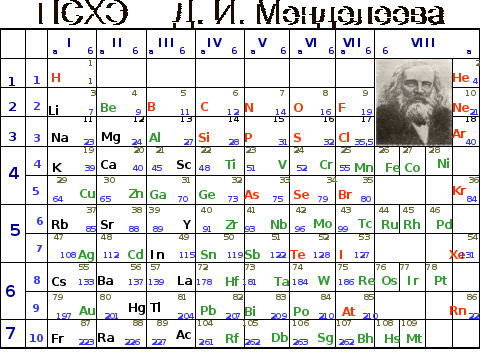
Слайд – 3. Закрепить знания о структуре периодической системы химических элементов.
Учитель: Весь мир большой: жара и стужа, Найдется ль правило простое,
Планет круженье, свет зари – Что целый мир объединит?
Все то, что видим мы снаружи, Таблицу Менделеев строит,
Законом связано внутри. Природы ищет алфавит…
Е. Ефимовский
Сейчас мы с вами вспомним как выглядит большой многоквартирный дом, который построил Д. И. Менделеев. Кто живет в этом доме?
(Учитель задает вопросы. После ответов учащихся на слайде появляются символы, соответствующие правильному ответу.)
Что такое период? Количество периодов в ПСХЭ.
Какие бывают периоды? Почему они так называются?
Что такое группа? Количество групп в ПСХЭ.
Как делится каждая группа?
Каждый химический знак в ПСХЭ обозначается своим химическим символом. Почему химические символы записаны различным цветом?
Что взял Д. И. Менделеев за основу систематизации химических элементов?
Что называется порядковым номером элемента?
Слайд – 4. Закрепить умение определять координаты элемента.

Учитель: Чтобы найти жильца в огромном доме необходимо знать его точный адрес.
К сожалению, на слайде дан неполный адрес. За 3 минуты определите по ПСХЭ недостающие координаты.
Работу выполняем по рядам: 1 ряд – первая строка, 2 ряд – вторая строка, 3 ряд – третья строка.
После выполнения задания ученики озвучивают ответ, символы появляются на экране. Учащиеся заполняют таблицу полностью.
Слайд – 5. Закрепить понятия относительная атомная и относительная молекулярная масса; закрепить умение вычислять значение относительной молекулярной массы.
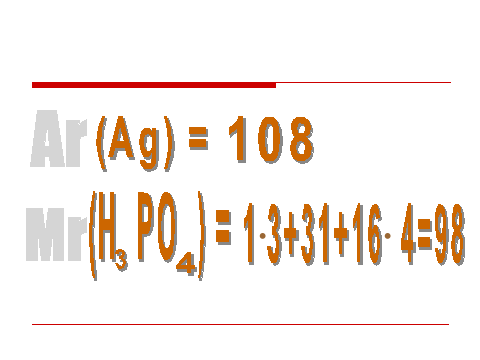
Учитель: Жилец каждой квартиры имеет особую примету. Именно она сыграла роль при распределении квартир. Что это за примета? Укажите ее для жильца, проживающего в 1-ом подъезде на 5-ом этаже.
Ученик: примета - относительная атомная масса (определение) ;жилец – серебро;
Аr (Ag) = 108 (Во время ответа ученика появляются символы слайда)
Учитель: Жильцы разных квартир очень дружны. Как правило, соседи часто собираются на корпоративные праздники, вечеринки, причем состав компании стараются не менять. (На экране формула фосфорной кислоты). Что вы можете сказать о составе данной группы? Какая у них особая примета?
Ученик: Рассказывает о составе фосфорной кислоты, дает определение относительной молекулярной массы, объясняет, как вычислить относительную молекулярную массу данного соединения.
Слайд – 6. Закрепить знания о строении атома.
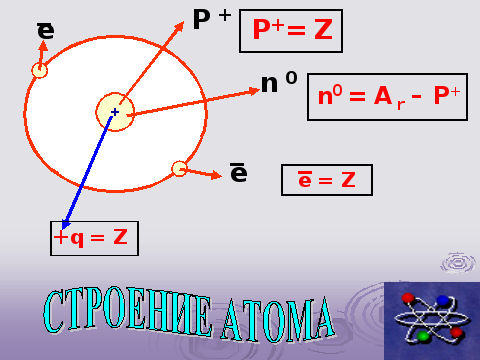
Учитель: Несколько последующих слайдов мы посвятим решению проблемы – каково внутреннее строение жильцов.
Из каких частиц они состоят? Какая координата в ПС влияет на их строение?
Ученик: Рассказывает о строении атома. (Чтобы ответ был полным и соответствовал слайду, учитель предлагает ученику план ответа)
Что находится в центре атома?
Как заряжено ядро?
Какие частицы вращаются вокруг ядра?
Какие частицы находятся в ядре?
Чему равна величина заряда ядра?
Как определить количество протонов в ядре?
Как определить общее количество электронов, вращающихся вокруг ядра?
Чему равно количество нейтронов в ядре?
Слайд – 7, 8. Закрепить умение выражать состав атома.

Учитель: На экране при помощи различных цифр и букв представлена запись, отражающая состав атома одного из жильцов. Расшифруйте ее.
Ученик: Объясняет значение каждой цифры. Почему количество протонов и нейтронов указано в скобках?
Учитель: Вы уже очень легко ориентируетесь в большом доме - ПС. Укажите, пожалуйста, состав атома хлора, исходя из его местоположения.
(На работу дается 2-3 минуты. Затем появляется слайд, по которому ученики могут проверить свои записи).

Учитель: Сравните составы атомов? Кем они доводятся друг для друга?
Ученик : Находит общие и отличительные черты. Дает определение изотопов.
Слайд – 9. Закрепить умение составлять и объяснять схему строения атома.
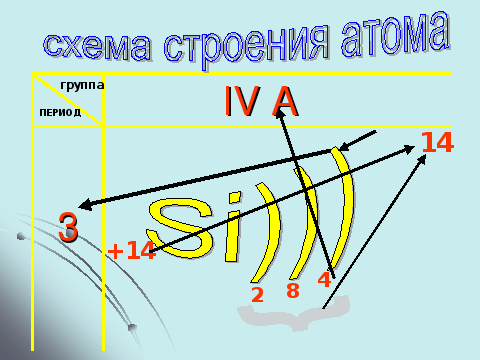
Учитель: Продолжаем изучать внутреннее строение атома. На экране указаны координаты проживания неизвестного жильца. Запишите схему его внутреннего строения. (2 мин) (Ученик, выполнивший задание первым, дает ответ. Учащиеся проверяют выполнение задания по записи на экране)
Учитель: Связана ли схема строения с координатами положения в ПС? Ответьте, пожалуйста на следующие вопросы: Чему соответствует величина заряда ядра?
Как определить количество энергетических уровней?
Чему соответствует общее количество электронов на энергетических уровнях?
Как вы определили количество электронов на последнем уровне?
Ученики отвечают на поставленные вопросы и дополняют схему.
Учитель: Рядом много электронов
Не живут определенно,
И уже на новый слой
Электрон восходит свой.
Число электронов от уровня к уровню возрастает. Как рассчитать наибольшее число электронов на данном уровне?
Слайд – 10. Закрепить знания о связи строения атома с положением его в ПСХЭ.

Учитель: Мы с вами пришли к выводу, что строение каждого атома зависти от его положения в ПС.
Соотнесите схемы строения атома и знаки химических элементов. На выполнения задания дается 3- 5 минут.
Слайд – 11. Изменение свойств атомов химических элементов в периодах.

На экране представлены схемы строения атомов лития, бериллия, бора. Что общего между данными химическими элементами? (расположены в одном периоде)
Как изменяются металлические и неметаллические свойства атомов химических элементов в периоде?
Почему?
Слайд – 12. Изменение свойств атомов химических элементов в группах.

1. На экране представлены схемы строения атомов бора, алюминия, таллия. Что
общего между данными химическими элементами? (расположены в одной группе)
2. Как изменяются металлические и неметаллические свойства атомов химических
элементов в группе?
Почему?
Слайд – 13. Образование ионов.

Что означает запись на экране?
Что называется ионом?
Как называется положительный ион?
Как называется отрицательный ион?
Слайд – 14. Схемы строения атомов и ионов.

I вариант – записать схемы строения атома кальция и иона кальция.
II вариант – записать схемы строения атома фосфора и иона фосфора Р 3-
Что общего в схемах строения ионов?
Приведите пример атома химического элемента, имеющего такое же строение.
Слайд – 15. Виды химических связей.

Что называется химической связью?
Какие виды химической связи вам известны?
Даны три элемента. Расположите элементы в порядке уменьшения электроотрицательности.
Что называется электроотрицательностью?
Что называется ковалентной неполярной связью?
Назовите формулы соединений с ковалентной неполярной связью, образованные данными элементами.
Что называется ковалентной полярной связью?
Назовите формулы соединений с ковалентной полярной связью, образованные данными элементами.
Что называется ионной связью?
Назовите формулы соединений с ионной связью, образованные данными элементами.
Что называется металлической связью?
Назовите формулы соединений с металлической связью, образованные данными элементами.
Слайд – 16. Схема образования ковалентной неполярной связи.
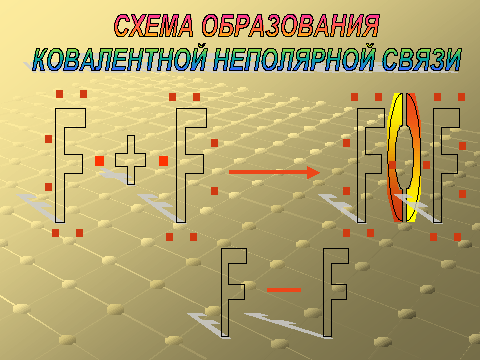
Схему образования ковалентной неполярной связи рассматриваем на примере образования молекулы фтора.
Прокомментировать изображение на слайде.
Слайд – 17. Схема образования ковалентной полярной связи.
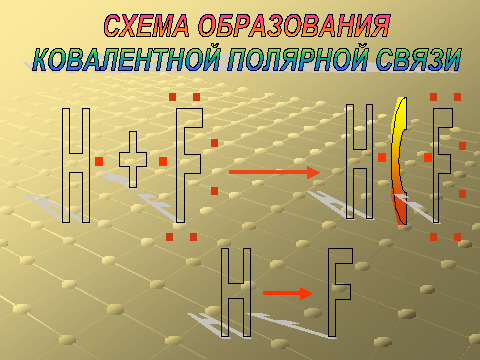
Схему образования ковалентной полярной связи рассматриваем на примере образования молекулы фтороводорода.
Объясните механизм образования связи.
Что общего и чем отличаются ковалентная неполярная и ковалентная полярная связи.
Слайд – 17. Схема образования ионной связи.

Схему образования инной связи рассматриваем на примере образования фторида натрия.
Слайд – 17. Схема образования металлической связи.