Открытый урок по химии на тему:

8 класс
Подготовила и провела: Газиева Эльмира Хабибовна
учитель биологии и химии
Цельурока: сформировать представление о классе бинарных соединений оксидах, их составе, номенклатуре, свойствах и получении.
Задачи
Образовательная – сформировать понятие об оксидах как об одном из классов химических соединений, изучить физические свойства и классификацию оксидов; изучить основные правила номенклатуры оксидов, определить значение оксидов в природе и жизни человека; познакомить учащихся с основными способами получения оксидов.
Развивающая – формировать умения сравнивать, выявлять общие признаки веществ, делать выводы, продолжить формирование исследовательских навыков учащихся при работе с различными источниками информации.
Воспитательная – воспитывать ответственность, самостоятельность, формировать коммуникативные качества обучающихся при организации работы в группах; формировать познавательный интерес, ценностное отношение к химии как науке и учебному предмету.
Основные понятия: оксиды, основные, кислотные, амфотерные, солеобразующие и несолеобразующие оксиды.
Оборудование и реактивы: компьютер, проектор, презентация, учебник – Рудзитис Г.Е., Фельдман Ф.Г., Химия. Неорганическая химия. 8 класс. – М.: «Просвещение», 2011. Бутылка газированной воды, медная проволока, спиртовка, спички, щипцы.
ХОД УРОКА
Организационный момент
Здравствуйте, мои дорогие! Я очень рада встрече с вами. И конечно жду той минуты, когда мы снова сможем заглянуть в этот Чудесный учебник. А вы этого желаете? Тогда вперед!
Актуализация знаний
Человека окружает огромное количество химических веществ. По составу они делятся на: простые и сложные.
- Вспомните, какие вещества называются простыми?
(Ответ). Простыми – называются вещества, которые образованны атомами одного химического элемента.
- Хорошо. Приведите примеры таких веществ?
(Ответ). O2, H2, Fe, Cu, Al и т.д.
- Молодцы. А какие вещества называются сложными?
(Ответ). Сложными – называются вещества, которые образованы атомами разных химических элементов.
- Приведите, пожалуйста, примеры таких веществ?
(Ответ). H2O, CO2, NaCl, сахар и т.д.
Изучение нового материала
План изложения материала:
Понятие – оксиды.
Классификация оксидов.
Номенклатура оксидов.
Физические свойства оксидов.
Химические свойства оксидов.
Основные способы получения оксидов.
Значение оксидов в природе и жизни человека.
Понятие – оксиды
Сложные вещества, в неорганической химии, делят на несколько групп: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ и СОЛИ.
На нашем уроке мы с вами подробнее познакомимся с классом – ОКСИДЫ. Вы уже с ними начинали немного знакомиться при изучении темы «Кислород».
-Вспомните, что же такое оксиды?
(Ответ). Оксиды – это сложные вещества, которые состоят из 2-х химических элементов, один из которых кислород. (2 слайд)
- Молодцы. Запишем тему нашего урока: «Оксиды».
Можно предположить, что общая формула оксидов имеет следующий вид: RxOy ,
где R – элемент (металл или неметалл), O – кислород, x и y – индексы, которые показывают количество атомов химического элемента и кислорода в оксиде. (3 слайд)
- Перед вами перечень веществ, выберите из него оксиды и назовите их.
NH3, CaO, HCl, CO2, H2O, CaCO3, SiO2, NaOH, CuO.
(После ответа учащихся, включаю следующий слайд).
(4 слайд) Ответ – CaO, CO2, H2O, SiO2, CuO.
- По каким признакам вы выбрали оксиды? В чем сходство этих химических соединений?
(Ответ). Наличие кислорода, сложные вещества, состоят из 2-х элементов (бинарные).
Классификация оксидов
- Сходство нашли. Теперь посмотрите внимательно и скажите, чем отличаются выбранные вами оксиды?
(Ответ). Обратите внимание, что в одних оксидах атом кислорода связан с атомом металла (CaO, CuO), а в других оксидах – с неметаллом (CO2, H2O, SiO2).
- Можно сказать, что оксиды делятся на оксиды металлов и оксиды неметаллов.
(5 слайд). В зависимости от того, с каким химическим элементом связан кислород, различают – КИСЛОТНЫЕ и ОСНОВНЫЕ оксиды. Но есть еще оксиды, которые называются амфотерные (их изучают позже).
НЕМЕТАЛЛЫ – образуют только кислотные оксиды.
МЕТАЛЛЫ – образуют и кислотные и основные оксиды.
Для металлов существует правило: Если валентность (свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента) в металлах меньше 4-х, то, как правило, образуются основные оксиды; если валентность больше 4-х – кислотные оксиды. (Пример кислотного оксида для металлов – CrO3 (H2CrO4-хромовая кислота); Mn2O7 (HMnO4 – марганцевая кислота).
(6 слайд). В зависимости от того, какие химические свойства проявляют оксиды, их называют:
СОЛЕОБРАЗУЮЩИМИ – оксиды, которые образуют соли (кислотные, основные, амфотерные)
НЕСОЛЕОБРАЗУЮЩИМИ (которые не образуют солей, и не проявляющие кислотных, основных и амфотерных свойств) –
(NO (монооксид азота, оксид азота (II)), N2O (оксид азота (I), закись азота), CO, SiO).
Запишите в тетрадь несолеобразующие оксиды.
Название оксидов
Любое из химических соединений имеет определенное название, так и оксиды. Их название начинается со слова «оксид» с добавлением названия второго химического элемента (металла или неметалла).
(7 слайд). Попробуем назвать следующие оксиды:
K2O – оксид калия, (основный)
FeO – оксид железа(II), (основный)
SO2 – оксид серы(IV), (кислотный)
MgO – оксид магния, (основный)
SiO2 – оксид кремния(IV), (кислотный)
Если элемент проявляет постоянную валентность, ее не указываем. Если же проявляет переменную валентность, то она указывается в скобках, римскими цифрами.
- Посмотрите, какие из предложенных оксидов относятся к кислотным? (SiO2, SO2) К основным
Способы получения оксидов
-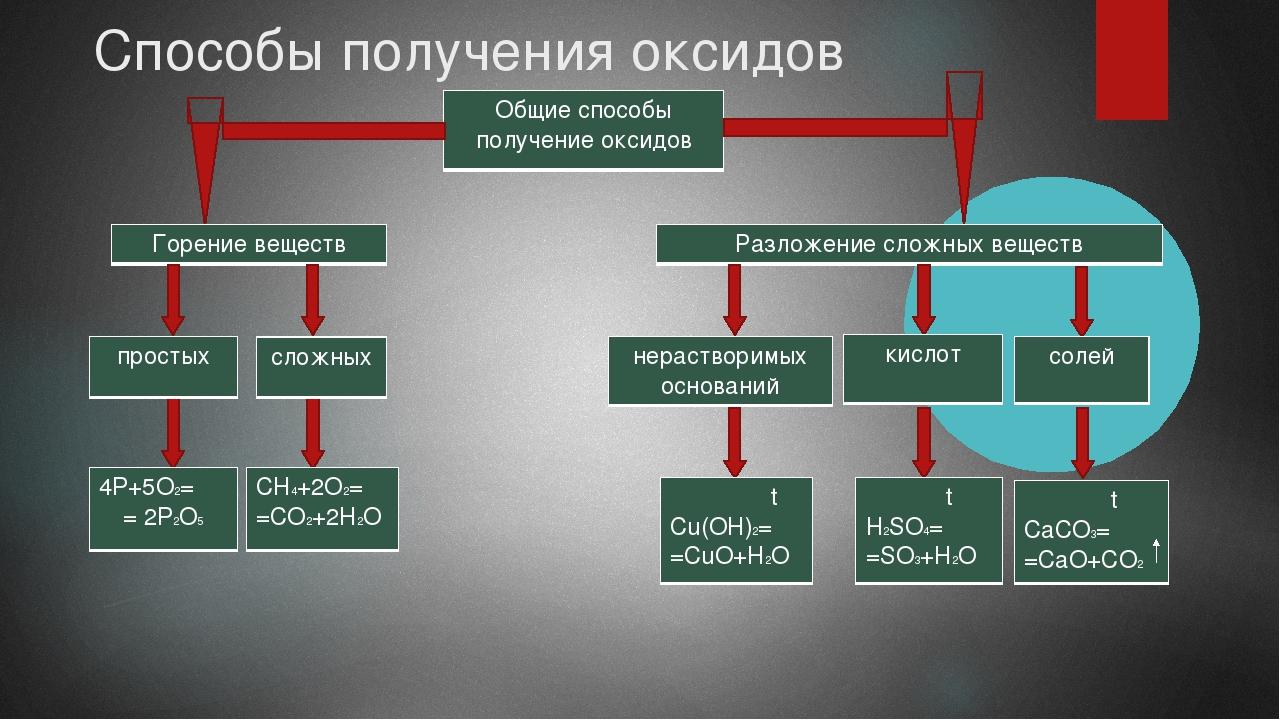 Как вы думаете, как можно получить оксиды?
Как вы думаете, как можно получить оксиды?
Оксиды получают двумя способами. (8 слайд)
Записываем пример горения простого вещества
4P + 5O2 = 2P2O5,
Показываю опыт по получению оксида меди.
В процессе демонстрации опыта повторить правила техники безопасности через вопросы:
-Как нужно потушить спиртовку после работы?
(Ответ). Накрыть колпачком.
-Почему проволоку при нагревании необходимо держать щипцами? (Ответ). Чтобы не обжечься.
Описание: медную проволоку скрутить в спираль, закрепить в щипцах и прокалить в пламени спиртовки.
Вопросы к опыту:
-Что произошло с медной проволокой?
(Ответ). Почернела.
- Как вы думаете, почему почернела проволока?
(Ответ). Произошла реакция.
- Связано ли наблюдаемое вами явление с кислородом?
(Ответ). Да. Потому что процесс горения поддерживается кислородом.
Запишем уравнение реакции проведенного опыта.
2Cu+O2=2CuO
(В результате реакции горения простых веществ, продуктом является только оксид).
При горении сложных веществ, в результате реакции образуются - оксид и выделяется вода. Запишем примеры получения оксидов:
2C2H2 + 5O2 = 4CO2 + 2H2O
2PH3 + 4O2 = P2O5 + 3H2O
(9 слайд). Посмотрим получение оксидов из сложных веществ, в результате разложения. (Показываю видео с получением оксида хрома).
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O (Это один из примеров разложения соли).
CaCO3 = CaO + CO2;
Разложение кислот: H2SO4 = SO3 + H2O
Разложение нерастворимых оснований: Cu(OH)2 = t CuO + H2O
Закрепление способов получения.
- Какие способы получения оксидов вы знаете?
- Какие продукты получаются в результате горения сложных веществ?
- Какие продукты получаются при горении простых веществ?
- Какие продукты реакции получаются при разложении веществ?
Физические свойства оксидов
- Любые вещества обладают физическими и химическими свойствами. Давайте вспомним, что относится к физическим свойствам?
(Ответ). Агрегатное состояние: твердое жидкое и газообразное.
Оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче воздуха.
В результате опыта с медной проволокой образовался нагар, который твердый по своим свойствам. Вода - оксид, по агрегатному состоянию – жидкая. Если открыть бутылку воды, то мы слышим шипение и видим пузырьки выделяющегося газа – это оксид углерода (углекислый газ).
Химические свойства оксидов
(10 слайд). Все оксиды, как кислотные, так и основные оксиды обладают разными свойствами. (Объясняю химические свойства, записываем в тетрадь.)
Основные оксиды
А) взаимодействие с кислотами: CuO + H2SO4 →t CuSO4 + H2O
Li2O + 2HNO3 = 2LiNO3 + H2O (получается соль и вода)
Б) взаимодействие с водой: Li2O + H2O → 2LiOH
CaO + H2O = Ca(OH)2 (получается основание)
Кислотные оксиды
А) взаимодействие с основаниями: CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO3 + 2NaOH = Na2SO4 + H2O (получается соль и вода)
Б) взаимодействие с водой: P2O5 + 3H2O →t 2H3PO4
N2O5 + H2O = 2HNO3 (получается кислота)
В) Менее летучие кислотные оксиды вытесняют более летучие из их солей:
CaCO3 + SiO2 →t CaSiO3 + CO2
3Na2CO3 + P2O5 = 2Na3PO4 + 3CO2 (получается соль и оксид)
Взаимодействие оксидов между собой:
CaO + CO2 → CaCO3
SiO2 + MgO = MgSiO3 (образуется соль)
- При взаимодействии чего образуется основание?
- В каких случаях продуктами реакции является соль и вода?
- При взаимодействии чего образуется кислота?
- Основание образуется при взаимодействии каких веществ?
- В каких случаях продуктами реакции является соль и оксид?
Значение оксидов в природе и жизни человека
Значение оксидов в промышленности и быту, а также для природных процессов - велика. (11,12,13 слайд)
В промышленности: Fe2O3 и Fe3O4 – применяют в производстве чугуна (сплав железа с углеродом) и стали; CaO и SiO2 – производство строительных материалов; CO2 – в пищевой промышленности для производства газированных напитков; H2O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д.
В быту: H2O – в питьевых и хозяйственных целях; SiO2 – входит в состав чистящих веществ; ZnO –входит в состав белой краски.
В природных процессах: H2O и CO2 – обеспечивают осуществление процессов фотосинтеза; H2O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д.
Подведение итогов урока.
- Что такое оксиды? (сложные вещества, которые состоят из 2-х химических элементов, один из которых кислород)
- С какой класификацией оксидов мы познакомились на уроке? (кислотными, основными, амфотерными)
- Какие оксиды образуют неметаллы? (кислотные)
- Какие оксиды образуют металлы? (основные и кислотные)
- Какими двумя способами получают оксиды? (горение веществ, разложение сложных веществ)
V. Рефлексия.

VI. Домашнее задание:
-- § 30 – прочитать, выучить определения
- упр. 1, 2.
(14 слайд). На этом наш урок окончен, благодарю за внимание. До свидания!







 Как вы думаете, как можно получить оксиды?
Как вы думаете, как можно получить оксиды?










