Просмотр содержимого документа
«Презентация к уроку химии в 9 классе "Углерод и его свойства"»

Углерод и его свойства.
Конова Антонина Дмитриевна , учитель химии МОУ «Степанщинская СОШ» Воскресенского района

Область соединений углерода так велика, что составляет особую отрасль химии, т. е. химии углеродистых, или, лучше, углеводородных, соединений.
Д. И. Менделеев, «Основы химии»

Углерод занимает 11-е место по распространенности (0,3% по массе). Он входит в состав:
- атмосферы в виде CO 2
- мела, известняка, мрамора (CaCO 3 )
- магнезита (MgCO 3 )
- доломита (MgCO 3 . CaCO 3 )
- малахита (CuCO 3 . Cu(OH) 2 )
- ископаемых углей, нефти, природного газа и т.д.

«Углерод – основа жизни…» - А. Е. Ферсман
- Углерод - важнейшая составная часть тканей всех растений и животных. В живых организмах его содержание 1 – 25% от живого веса и до 45% от сухой массы растений.
- Атомы углерода могут соединяться между собой в длинные цепи, образуя громадное число органических соединений: белки углеводы, жиры, витамины и др.

Неорганические
вещества:
CO, CO 2 ,
угольная кислота
и ее соли
Органические
Органические
вещества:
вещества:
CH 4 , муравьиная кислота, бензол, ацетон, пропан
CH 4 , муравьиная кислота, бензол, ацетон, пропан и др.
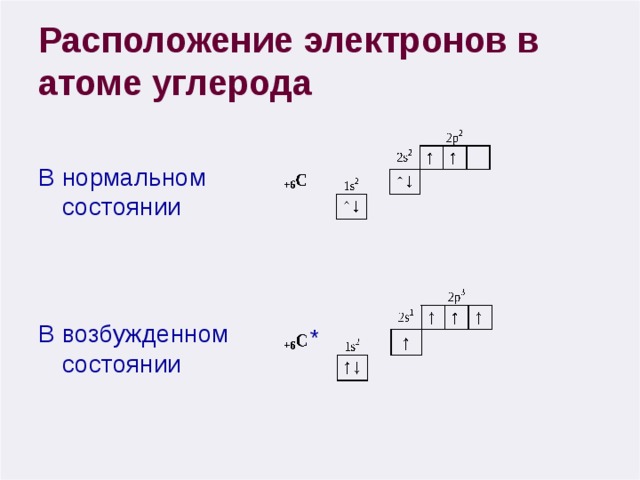
Расположение электронов в атоме углерода
В нормальном состоянии
В возбужденном состоянии
*

Аллотропные модификации
углерода
Алмаз
Графит
Карбин
Фуллерен
Аморфный углерод

Алмаз
- Самое твердое вещество, найденное в природе.
- Бесцветен, хотя встречаются и окрашенные образцы
- Кристаллы сильно преломляют свет.
- Не проводит электрический ток.




Графит
- Мягок, легко расслаивается на отдельные чешуйки.
- Непрозрачен, серого цвета, обладает металлическим блеском.
- Тугоплавок.
- Проводит электрический ток.


1800-1850 ºС,
без воздуха
3000 ºС,
р = 6 * 10 6 - 10 10 кПа
Графит
Алмаз

Карбин
- Порошок черного цвета.
- По твердости занимает промежуточное положение между алмазом и графитом.
- Обладает полупроводниковыми свойствами.
− C≡C−C≡C−C≡C−
═ C═C═C═C═C═C═
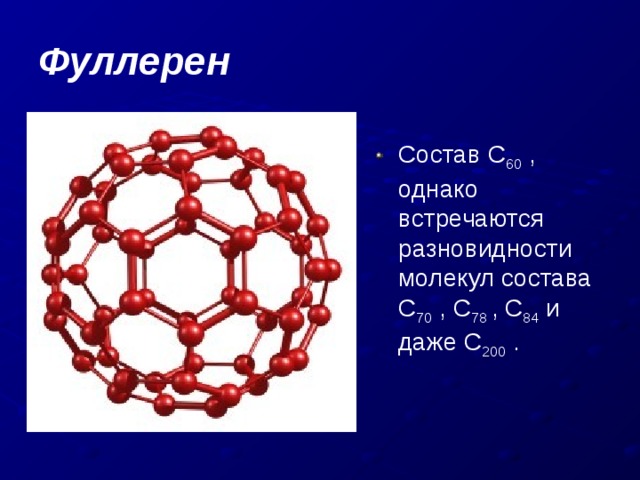
Фуллерен
- Состав С 60 , однако встречаются разновидности молекул состава С 70 , С 78 , С 84 и даже С 200 .

Аморфный углерод
- Каменный уголь
- Кокс - получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии в качестве восстановителя.
- Древесный уголь - образуется при сухой перегонке древесины, обугливании древесины.
- Активированный уголь - получают при нагревании древесного угля в струе водяного пара.
- Сажа - сжигание углеводородов при ограниченном доступе воздуха.

Адсорбция – поглощение газообразных или растворенных веществ поверхностью твердого вещества.
Десорбция – выделение поглощенных веществ.

Применение активированного угля - о чистка газов и растворов от нежелательных веществ.
- Противогаз.
- Бытовые фильтры для воды.
- В пищевой промышленности – очистка сахара.
- В медицине – первая помощь при пищевых отравлениях
Историческая справка
22 апреля 1915 года в районе Ипра на стыке французского и британского фронтов немцы осуществили первую газобаллонную химическую атаку. В результате из 12 тысяч солдат в живых осталось только 2 тысячи.
После этого Николай Дмитриевич Зелинский поставил задачу отыскать надежное средство защиты от отравляющих газов. Проведя ряд исследований, он пришел к идее использовать обыкновенный древесный уголь. Н.Д. Зелинский вместе с В.С. Садиковым разработал способ активирования угля путем прокаливания, что значительно увеличило его поглотительную способность.
К середине 1916 года было налажено массовое производство противогазов. Всего за годы Первой мировой войны в действующую армию было направлено более 11 миллионов противогазов, что спасло жизнь миллионам русских солдат.
Николай Дмитриевич Зелинский (1861-1953) — российский химик-органик, автор фундаментальных открытий в области синтеза углеводородов, органического катализа, каталитического крекинга нефти, гидролиза белков и противохимической защиты, создатель научной школы, один из основоположников органического катализа и нефтехимии, академик АН СССР (1929), Герой Социалистического Труда (1945).
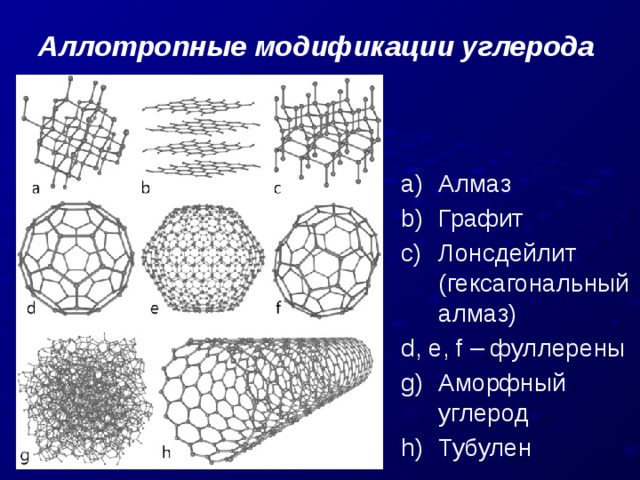
Аллотропные модификации углерода
- Алмаз
- Графит
- Лонсдейлит (гексагональный алмаз)
d, e, f – фуллерены

Причины аллотропии углерода:
- Самый маленький атом в группе.
- Атом с самой высокой валентностью среди элементов своего периода.
- Большая электронная плотность на валентных орбиталях.
- Прочные химические связи

Химические свойства углерода
С - восстановитель
Сº - 4ē С +4
С - окислитель
Сº + 4ē Сˉ 4
Сº - 2ē С +2
- С + 2Н 2 = СН 4
- 2С + Са = СаС 2
- 3С + 4Al = Al 4 C 3
- C + Si = SiC
- C + O 2 = CO 2
- 2C + O 2 = 2CO
- C + 2CuO = 2Cu + CO 2
- 3C + CaO = CaC 2 + CO


Задание : В ряду веществ исключите «лишнее» вещество и обоснуйте ваше решение.
- Алмаз
- Озон
- Карбин
- Графит
- Фуллерен
- Углерод
- Алмаз
- Карбид
- Графит
- Карбин

Ответы к тесту
Вариант 1
Вариант 2
- 1 – г
- 2 – а
- 3 – а
- +4, -4, +4
- SiC
- 1 – г
- 2 – в
- 3 – в
- -4, +2, -4
- CaC 2









































