
СОЛИ В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Презентация к уроку химии
для 8 класса
Учитель химии МБОУ СШ № 16
г. Новый Уренгой
Батырова Раиля Бадртдиновна

Цели урока
- Рассмотреть классификацию солей;
- Ознакомить с общими свойствами солей в свете ионных представлений.

ТЕСТ
1.Определите ряд формул, состоящих только из
1 вариант КИСЛОТНЫХ ОКСИДОВ 2 вариант- ОСНОВНЫХ ОКСИДОВ
а) Na 2 O, N 2 O, CuO б) CO 2 , P 2 O 5 , Cl 2 O 7 в) MgO, BaO, Na 2 O г) Li 2 O, CaO, CO
2.Выберите из списка веществ формулы только
1 вариант КИСЛОТ 2 вариант- ОСНОВАНИЙ
а) НСl, AlCl 3 , CO 2 , H 2 SO 4 б) H 2 SO 4 , HCl, HNO 3 , HF
в) NaOH, BaCl 2 , CO, Ca(OH) 2 г) Al(OH) 3 , NaOH, KOH, Ba(OH) 2
3. Выберите формулу
1 вариант ОКСИДА СЕРЫ (IV ) 2 вариант- ОКСИДА УГЛЕРОДА (II)
а)H 2 S б) CO в) HNO 3 г) ZnO д) SO 2
4.Выберите формулу
1 вариант СЕРНОЙ КИСЛОТЫ 2 вариант- ГИДРОКСИДА КАЛЬЦИЯ
а) KOH б) H 2 SO 4 в) H 2 SO 3 г) Ca(OH) 2
5.Закончите молекулярное уравнение реакций и запишите соответствующее
ионное уравнение
1 вариант : Fe(OH) 2 + HNO 3 → 2 вариант: NaOH + H 2 SO 4 →

Соли – электролиты, которые при диссоциации образуют катионы металла (или аммония NH 4 + ) и анионы кислотных остатков
Na 2 SO 4 ↔ 2Na + + SO 4 2-
катион
анион
металла
кислотного
остатка
NH 4 Cl ↔
NH 4 +
Cl -
+
катион
аммония
анион
хлора
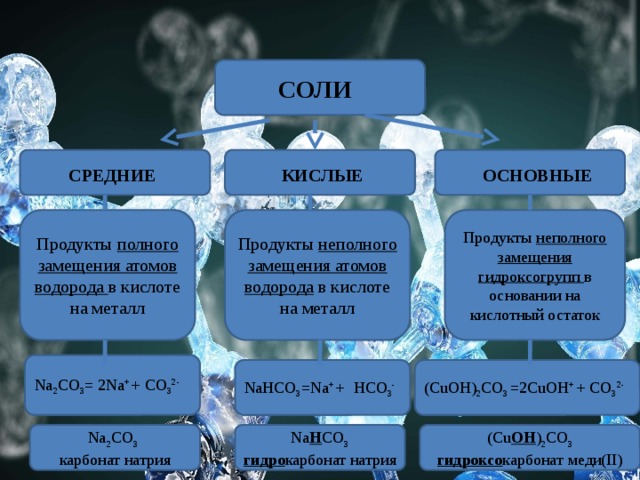
СОЛИ
ОСНОВНЫЕ
КИСЛЫЕ
СРЕДНИЕ
Продукты неполного замещения атомов водорода в кислоте на металл
Продукты неполного замещения гидроксогрупп в основании на кислотный остаток
Продукты полного замещения атомов водорода в кислоте на металл
Na 2 СO 3 = 2Na + + СO 3 2-
NaНСO 3 =Na + + НСO 3 -
(CuOH) 2 СO 3 =2CuOH + + СO 3 2-
Na 2 СO 3
Na Н СO 3 гидро карбонат натрия
(Cu OH ) 2 СO 3 гидроксо карбонат меди(II)
карбонат натрия

ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
1. СОЛЬ + КИСЛОТА → другая СОЛЬ + другая КИСЛОТА ( ↓ или ↑) р.обмена
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Ba 2+ + 2Cl - + 2H + + SO 4 2- → BaSO 4 ↓ + 2H + + 2Cl -
Ba 2+ + SO 4 2- → BaSO 4 ↓
Na 2 CO 2 + 2HCl → 2NaCl + CO 2 ↑+ 2H 2 O
2Na + + CO 3 2- + 2H + + 2Cl - → 2Na + + 2Cl - + CO 2 ↑+ 2H 2 O
CO 3 2- + 2H + → CO 2 ↑ + 2H 2 O

ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
2. СОЛЬ (Р) + ЩЕЛОЧЬ → другая СОЛЬ + другое ОСНОВАНИЕ ( ↓ ) р.обмена
Cu SO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4 2-
Cu 2+ + SO 4 2- + 2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2-
Cu 2+ + 2OH - → Cu(OH) 2 ↓

ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
3. СОЛЬ (Р)1 + СОЛЬ (Р)2 → СОЛЬ 3 + СОЛЬ 4 ( ↓ ) р обмена
NaCl + AgNO 3 → AgCl↓ + NaNO 3
Na + + Cl - + Ag + + NO 3 - → AgCl↓ + Na + + NO 3 -
Ag + + Cl - → AgCl↓

ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
СОЛЬ (Р) + МЕТАЛЛ → другая СОЛЬ + другой МЕТАЛЛ р.замещения
CuSO 4 + Zn → Cu + ZnSO 4
Cu 2+ + SO 4 2- + Zn 0 → Cu 0 + Zn 2+ + SO 4 2-
Cu 2+ + Zn 0 → Cu 0 + Zn 2+

Ряд напряжений металлов:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H 2 , Cu, Hg, Ag, Au
С растворами КИСЛОТ взаимодействуют МЕТАЛЛЫ, которые расположены ЛЕВЕЕ ВОДОРОДА в соответствии с электрохимическим рядом напряжений металлов.
Вытеснительный ряд металлов:
Mg, Al, Zn, Cr, Fe, Co, Sn, Pb, H 2 , Cu, Hg, Ag, Au
Каждый МЕТАЛЛ вытесняет из РАСТВОРА СОЛЕЙ другие металлы, расположенные ПРАВЕЕ его в электрохимическом ряду напряжений металлов.

вступают в химическое взаимодействие
СОЛИ
c
кислотами,
щелочами,
солями,
металлами

Из перечня формул выпишите отдельно формулы средних , кислых и основных солей, дайте им названия
Ca(HSO 4 ) 2 , (CuOH) 2 SO 4 , Zn(NO 3 ) 2 , NaH 2 PO 4 , K 3 PO 4 , MgOHNO 3 , FeCl 3 , (CaOH) 2 SO 3 , Na 2 CO 3 , NaHCO 3
СРЕДНИЕ
КИСЛЫЕ
ОСНОВНЫЕ

Напишите молекулярные уравнения реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения
I вариант
II вариант
Гидроксид калия + хлорид железа (III)
Карбонат натрия + серная кислота




























