СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Методические рекомендации по выполнению лабораторных работ по дисциплине "Химия"
Методические рекомендации по выполнению лабораторных работ по химии для 1 курса СУЗ.
Просмотр содержимого документа
«Методические рекомендации по выполнению лабораторных работ по дисциплине "Химия"»
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Уважаемый студент!
Данные методические рекомендации по дисциплине «Химия» для студентов профессии технического профиля 09.01.03 Мастер по обработке цифровой информации помогут Вам организовать свою работу на лабораторных занятиях.
Лабораторные задания выполняются в тетрадях для лабораторных занятий по учебной дисциплине. Все записи в процессе выполнения ведутся аккуратно.
Приступая к выполнению лабораторных заданий, Вам необходимо внимательно прочитать цель занятия, ознакомиться с краткими теоретическими и учебно-методическими материалами по теме лабораторного занятия.
Наличие положительной оценки по лабораторным занятиям необходимо для получения дифференцированного зачета по учебной дисциплине «Химия», который проводится по окончании изучения дисциплины.
Пропуски лабораторных занятий без уважительной причины не допускаются. При отсутствии на лабораторном занятии лабораторные задания выполняются в сроки, дополнительно согласованные с преподавателем.
Если в процессе подготовки к лабораторным занятиям или при их выполнении у Вас возникают вопросы, разрешить которые самостоятельно не удается, обращайтесь к преподавателю для получения консультации.
Желаем Вам успехов!
| Содержание | Стр. |
| Пояснительная записка | 3 |
| Лабораторное занятие №1 Приготовление суспензии карбоната кальция в воде | 5-7 |
| Лабораторное занятие №2 Получение эмульсии моторного масла | 5-7 |
| Лабораторное занятие №3 Ознакомление со свойствами дисперсных систем | 5-7 |
| Лабораторное занятие №4 Приготовление ненасыщенного раствора | 8-9 |
| Лабораторное занятие №5 Приготовление насыщенного раствора | 8-9 |
| Лабораторное занятие №6 Приготовление раствора заданной концентрации | 8-9 |
| Лабораторное занятие №7 Испытание растворов кислот индикаторами | 10-11 |
| Лабораторное занятие №8 Взаимодействие металлов с кислотами | 12-13 |
| Лабораторное занятие №9 Взаимодействие кислот с оксидами металлов | 14 |
| Лабораторное занятие №10 Взаимодействие кислот с основаниями | 15 |
| Лабораторное занятие №11 Взаимодействие кислот с солями | 16 |
| Лабораторное занятие №12 Испытание растворов щелочей индикаторами | 17-18 |
| Лабораторное занятие №13 Взаимодействие щелочей с солями | 19-22 |
| Лабораторное занятие №14 Реакция замещения меди железом в растворе медного купороса | 19-22 |
| Лабораторное занятие №15 Реакции, идущие с образованием осадка, газа или воды | 19-22 |
| Лабораторное занятие №16 Зависимость скорости взаимодействия соляной кислоты с металлами от их природы | 19-22 |
| Лабораторное занятие №17 Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации | 19-22 |
| Лабораторное занятие №18 Зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры | 19-22 |
| Лабораторное занятие №19 Взаимодействие солей с металлами, с солями | 23-24 |
| Лабораторное занятие №20 Получение, собирание и распознавание газов | 25-27 |
| Лабораторное занятие №21 Изготовление моделей молекул органических веществ | 28-29 |
| Лабораторное занятие №22 Ознакомление с коллекцией образцов нефти | 30-31 |
| Лабораторное занятие №23 Ознакомление с коллекцией продуктов переработки нефти | 30-31 |
| Лабораторное занятие №24 Ознакомление с коллекцией каучуков и образцами изделий из резины | 32-33 |
| Лабораторное занятие №25 Растворение глицерина в воде и взаимодействие с гидроксидом меди (II) | 34-35 |
| Лабораторное занятие №26 Свойства уксусной кислоты, общие со свойствами минеральных кислот | 36-37 |
| Лабораторное занятие №27 Взаимодействие глюкозы и сахарозы с гидроксидом меди (II) | 38 |
| Лабораторное занятие №28 Качественная реакция на крахмал | 40-41 |
| Лабораторное занятие №29 Растворение и осаждение белков | 42-43 |
| Лабораторное занятие №30 Цветные реакции белков | 42-43 |
| Список рекомендуемых источников | 44 |
Лабораторное занятие №1
ПРИГОТОВЛЕНИЕ СУСПЕНЗИИ КАРБОНАТА КАЛЬЦИЯ В ВОДЕ
Лабораторное занятие №2
ПОЛУЧЕНИЕ ЭМУЛЬСИИ МОТОРНОГО МАСЛА
Лабораторное занятие №3
ОЗНАКОМЛЕНИЕ СО СВОЙСТВАМИ ДИСПЕРСНЫХ СИСТЕМ
Цель занятий 1 - 3: закрепить полученные теоретические знания о суспензиях, дисперсных системах.
Студент должен:
уметь: проводить эксперимент, соблюдая технику безопасности; получать дисперсные системы и исследовать их свойства;
знать: определение, виды, способы приготовления суспензий;
иметь сформированные компетенции: использование достижений современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Обеспеченность занятия
Оборудование и реактивы: дистиллированная вода; вещества и растворы: карбонат кальция, масло, раствор глицерина, мука, желатин; фарфоровая чашка; пробирки, штатив.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторных занятий 1 - 3
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные (дисперсные) системы.
Дисперсными называют гетерогенные системы, в которых одно вещество - дисперсная фаза (их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы:
Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это эмульсии, суспензии, аэрозоли.
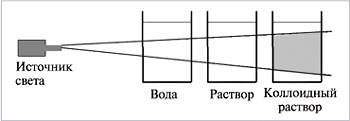
Тонкодисперсные- с размерами частиц от 100 до 1 нм. Фаза и среда в таких системах отстаиванием разделяются с трудом. Это золи (коллоидные растворы- "клееподобные" ) и гели (студни).
| Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. |
|
| Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса Различают 8 типов дисперсных систем (д/с + д/ф):
| |
Содержание отчёта по выполнению лабораторных заданий 1 - 3
1. Напишите название, тему, цель лабораторного занятия.
2. С помощью краткого теоретического материала по теме занятий выполните предложенные задания:
| Опыт | Результат | |||
| Опыт №1 Приготовление суспензии карбоната кальция в воде.
| В стеклянную пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть несколько раз. | Наблюдения: *Внешний вид и видимость частиц:____________________________ ____________________________________ ____________________________________ *Способность осаждаться и способность к коагуляции ___________ ____________________________________ ____________________________________
| ||
| Опыт №2 Приготовление эмульсии масла в воде и изучение ее свойств
| В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина. | Наблюдения: *Внешний вид и видимость частиц: _________________________________ _________________________________ _________________________________ *Способность осаждаться и способность к коагуляции _________________________________ _________________________________ _________________________________ *Внешний вид после добавления глицерина _______________________ ________________________________ ________________________________ | ||
| Опыт №3 Приготовление коллоидного раствора и изучение его свойств | В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги | Наблюдения: *Внешний вид и видимость частиц _________________________________ _________________________________ _________________________________ *Способность осаждаться и способность к коагуляции__________ _________________________________ _________________________________ _________________________________ *Наблюдается ли эффект Тиндаля _________________________________ _________________________________ _________________________________ | ||
Сформулируйте и запишите общий вывод о проделанных опытах.
Вопросы для закрепления теоретического материала практического занятия
Что такое суспензии? Приведите 3 примера суспензий.
Что такое агрегатное состояние веществ? Приведите по 2 примера каждого агрегатного состояния веществ.
Перечислите составляющие дисперсных систем.
Охарактеризуйте грубодисперсные системы. Приведите 3 примера.
Дайте определение эффекту Тиндаля. Приведите пример явления коагуляции.
Лабораторное занятие №4
ПРИГОТОВЛЕНИЕ НЕНАСЫЩЕННОГО РАСТВОРА
Лабораторное занятие №5
ПРИГОТОВЛЕНИЕ НАСЫЩЕННОГО РАСТВОРА
Лабораторное занятие №6
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ
Цель занятий 4 - 6: закрепить знания о важнейших химических понятиях: массовая доля растворенного вещества, масса раствора, масса вещества, насыщенный и ненасыщенный, концентрированный и разбавленный растворы.
Студент должен:
уметь: совершать лабораторные операции: взвешивание, отбор проб твердых и жидких веществ, приготовление раствора;
знать: правила техники безопасности при обращении с химическими реактивами, понятия массовая доля, раствора, вещества;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: стеклянная лопаточка; стакан объемом 50 мл; стеклянная палочка с резиновым наконечником; мерный цилиндр; весы; холодная кипяченая вода, соли.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторных занятий 4 – 6
Раствор- это однородная система, состоящая из растворителя, растворенных веществ и продуктов их взаимодействия. Растворителем чаще всего является то вещество, которое в чистом виде имеет тоже агрегатное состояние, что и раствор, либо присутствует в избытке.
По агрегатному состоянию различают растворы: жидкие, твердые, газообразные. По соотношению растворителя и растворенного вещества: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Состав раствора обычно передается содержанием в нем растворимого вещества в виде массовой доли, процентной концентраций и молярности.
Массовая доля (безразмерная величина) – это отношение массы растворенного вещества к массе всего раствора:
Wм .д .= mраст. вещества /mраствора.
Процентная концентрация (%) – это величина показывающая сколько грамм растворенного вещества cсодержится в 100 гр. раствора:
W% = mраст. вещества 100% /mраствора
Молярная концентрация, или молярность (моль/литр)- это величина показывающая сколько молей растворимого вещества содержатся в 1 литре раствора:
См = mраст. вещес/Мr(раст. вещества )V раствора.
Содержание отчёта по выполнению лабораторных заданий 4 – 6
1. Напишите название, тему, цель лабораторных занятий.
2. Пользуясь кратким теоретическим материалом по теме лабораторных занятий 4 – 6, выполните предложенные задания:
Задание 1. Приготовление раствора соли с определенной массовой долей вещества.
Задача: определите, какую массу соли и воды потребуется взять для приготовления 20 г водного раствора поваренной соли с массовой долей соли 5 %.
Произведите расчеты:
| Дано:
Найти: | Решение: |
|
|
Приготовьте раствор. Для этого:
Отвесьте соль и поместите ее в стакан.
Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Задание 2. Приготовление раствора с заданной молярной концентрацией.
Задача: определите, какую массу соли и воды потребуется взять для приготовления 25 мл раствора хлорида калия, молярная концентрация которого 0,2 моль/л.
Произведите расчеты:
| Дано:
Найти: | Решение: |
|
|
Приготовьте раствор.
В соответствии с расчетами возьмите навеску соли, поместите ее в мерный стакан и добавьте немного воды (примерно 7-10 мл). помешивая стеклянной палочкой, растворите полностью соль, а затем прилейте воды до необходимого по условию задачи объема.
Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторных занятий 4 – 6
Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта
Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ный формалин.
Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе.
Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %-ного раствора (плотность 1,24 г/мл).
Определите массовую долю (%) нитрита железа (II), если из 4 кг 15% раствора выпарили 1 кг.
Лабораторное занятие №7
ИСПЫТАНИЕ РАСТВОРОВ КИСЛОТ ИНДИКАТОРАМИ
Цель занятия: научиться определять реакцию среды с помощью индикаторов, проводить реакции взаимодействия кислот с металлами, оксидами металлов, гидроксидов с кислотами, солей со щелочами, металлами и солями.
Студент должен:
уметь: совершать лабораторные операции: взвешивание, отбор проб твердых и жидких веществ, приготовление раствора;
знать: правила техники безопасности при обращении с химическими реактивами, виды индикаторов;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: штатив с пробирками, индикаторная бумага, стеклянная палочка, вода, растворы лакмуса, фенолфталеина, серной кислоты, соляной кислоты, гидроксида натрия, магний (порошок), оксид магния,
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Лакмусовая бумага является дешевым быстродействующим средством для определения кислой или основной среды.
Лакмусовая бумага получается путем нанесения лакмуса на обыкновенную пористую бумагу. Лакмус добывается непосредственно из определенного вида лишайников, которые являются симбиозом водорослей и грибков.
Лакмус бывает трех видов:
красный лакмус - используется для определения оснований;
синий лакмус - для кислот;
нейтральный лакмус - используется для определения как кислот, так и оснований.
Фенолфталеин является прозрачной жидкостью, которая остается бесцветной в кислой среде, и меняет свой цвет на малиновый - в щелочной.
Основное применение фенолфталеин нашел в процессах титрования, когда концентрация кислоты (основания) определяется путем реакции нейтрализации основанием (кислотой) известной концентрации.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия, выполните предложенные задания:
Задание 1. Налейте в 3 пробирки по несколько капель воды и прибавьте в каждую раствор лакмуса до хорошо заметной окраски. Какой цвет имеет лакмус в водной среде? В одну из пробирок добавьте 2-3 капли серной кислоты, а в другую- 2-3 капли гидроксида натрия. Третью пробирку оставьте без изменения для сравнения полученных результатов. Как изменилась окраска растворов? Наблюдения за изменением окраски занесите в таблицу.
| Выполняли | Наблюдали |
|
|
|
Повторите опыт, используя вместо лакмуса фенолфталеин.
Задание 2. Налейте в 2 пробирки по 2-3 капли соляной кислоты. В одну пробирку добавьте немного порошка магния, а в другую- оксида магния. Как взаимодействуют кислоты с металлами и оксидами металлов? Запишите наблюдения. Составьте уравнения реакций взаимодействия соляной кислоты с магнием и оксидом магния.
Задание 3. Налейте в пробирку 2-3 капли гидроксида натрия и добавьте 1 каплю фенолфталеина. Как изменилась окраска раствора? Добавьте в пробирку 2-3 капли раствора соляной кислоты. Запишите наблюдения. Составьте уравнение реакции взаимодействия гидроксида натрия с соляной кислотой.
Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Какие химические индикаторы Вы знаете? Перечислите изменение их окраски в растворах кислот и щелочей.
Охарактеризуйте фенолфталеин и лакмус.
Напишите химическую реакцию взаимодействия серной кислоты и оксида магния.
Сравните реакции кислот с металлами и оксидами металлов.
Приведите примеры химических реакций кислот с оксидами неметаллов.
Лабораторное занятие №8
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОТАМИ
Цель занятия: изучить восстановительные свойства металлов, их взаимодействие с кислотами.
Студент должен:
уметь: совершать лабораторные операции: взвешивание, отбор проб твердых и жидких веществ, приготовление раствора;
знать: правила техники безопасности при обращении с химическими реактивами, понятия восстановительных свойств, формулы кислот, металлов;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: пробирки, раствор соляной кислоты, порошок железа, медь, цинк, магний.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Физические свойства металлов. В обычных условиях все металлы, кроме ртути, - твердые вещества, резко отличающиеся по степени твердости.
Металлы, являясь проводниками первого рода, обладают высокой электропроводностью и теплопроводностью. Эти свойства связаны со строением кристаллической решетки, в узлах которой находятся ионы металлов, между которыми перемещаются свободные электроны. Перенос электричества и тепла происходит за счет движения этих электронов.
Химические свойства металлов. Все металлы являются восстановителями, т.е. при химических реакциях они теряют электроны и превращаются в положительно заряженные ионы.
Соляная и разбавленная серная кислоты реагируют с металлами, стоящими в ряду напряжений до водорода. При этом образуется соответствующая соль и выделяется водород.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия, выполните предложенные задания:
Задание 1. Сравнение восстановительных свойств металлов
В четыре пробирки поместите по 8 капель разбавленной соляной кислоты. В первую пробирку внесите кусочек магния, во вторую – железа, в третью – меди, в четвёртую – цинка. Опишите наблюдения; напишите уравнения реакций.
Задание 2. Взаимодействие железа с разбавленной и концентрированной соляной кислотой В две пробирки внесите по 8–10 капель разбавленной соляной кислоты и немного порошкообразного железа. Для ускорения реакции пробирки слегка подогрейте. Затем в первой пробирке проведите качественную реакцию на ионы железа (II):
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl,
а во второй – на ионы железа (III):
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl.
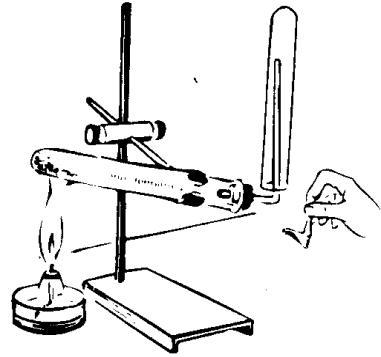
При наличии в первой пробирке ионов Fe2+ образуется темно-синий осадок турнбулевой сини, а во второй пробирке при наличии ионов Fe3+ – кроваво-красный раствор роданида трёхвалентного железа (при малой концентрации ионов Fe3+ наблюдается слабое окрашивание раствора). Затем повторите опыт от начала до конца, заменив разбавленную соляную кислоту на концентрированную. Опишите опыт.
Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Объясните, почему в 1 задании при проведении опыта в третьей пробирке реакция не происходит?
Составьте уравнения двух возможных реакций железа с соляной кислотой и объясните, какая из них более вероятна и как влияет увеличение концентрации HCl на её протекание.
В чем отличие реакции железа с соляной и серной кислотами?
Напишите уравнение химической реакции меди с угольной кислотой.
Сформулируйте правила взаимодействия металлов с кислотами.
Лабораторное занятие №9
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОКСИДАМИ МЕТАЛЛОВ
Цель занятия: изучить свойства оксидов металлов, их взаимодействие с кислотами.
Студент должен:
уметь: совершать лабораторные операции: взвешивание, отбор проб твердых и жидких веществ, приготовление раствора;
знать: правила техники безопасности при обращении с химическими реактивами, понятия кислот, оксидов, свойств оксидов металлов;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: пробирки, раствор соляной кислоты, серной кислоты, оксид меди (II).
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Кислоты взаимодействуют с оксидами металлов с образованием растворимой соли и воды.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия, выполните предложенные задания:
Задание 1. Проведите реакцию взаимодействия соляной кислоты с оксидом меди. Запишите уравнение проделанных Вами реакций в молекулярной и ионной формах.
Задание 2. Проведите реакцию взаимодействия серной кислоты с оксидом меди. Запишите уравнение проделанных Вами реакций в молекулярной и ионной формах.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Напишите структурные формулы серной и соляной кислот.
Охарактеризуйте химические свойства оксида меди (II).
Какие химические соединения образуются в результате взаимодействия оксидов и кислот?
В чем отличие между взаимодействием оксида меди с серной и соляной кислотами?
Напиши уравнение реакции взаимодействия серной кислоты и оксида лития.
Лабораторное занятие №10
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВАНИЯМИ
Цель занятия: изучить свойства кислот, их взаимодействие с щелочами.
Студент должен:
уметь: составлять уравнения химических реакций;
знать: химические свойства кислот, оснований; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Кислоты взаимодействуют с основаниями, образуя соль и воду.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните предложенные задания:
Задание 1. Составьте уравнение химической реакции соляной кислоты и гидроксида бария. Запишите уравнение реакции в молекулярной и ионной формах.
Задание 2. Составьте уравнение химической реакции взаимодействия серной кислоты с гидроксидом натрия. Запишите уравнение реакции в молекулярной и ионной формах.
3.Сформулируйте и запишите вывод о химических свойствах кислот.
Вопросы для закрепления теоретического материала лабораторного занятия
Как называется химическая реакция между кислотой и гидроксидом?
Какие продукты получаются в результате реакции между кислотой и гидроксидом?
В каком случае кислота способна вытеснять другую кислоту из соли?
С помощью каких реакций можно различить соляную, серную и азотную кислоты?
Напишите уравнение реакции взаимодействия гидроксида магния и соляной кислоты. Расставьте необходимые коэффициенты.
Лабораторное занятие №11
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ
Цель занятия: изучить взаимодействие кислот с солями.
Студент должен:
уметь: составлять уравнения химических реакций;
знать: химические свойства кислот, солей; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Реакции обмена между кислотами и солями возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок), образуется летучее вещество (газ) или слабый электролит.
А) Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок.
Например, при взаимодействии раствора серной кислоты с раствором хлорида бария в осадок выпадает сульфат бария, а при взаимодействии раствора силиката натрия с раствором азотной кислоты в осадок выпадает кремниевая кислота:
H2SO4+BaCl2→BaSO4↓+2HCl;
Na2SiO3+2HNO3→H2SiO3↓+2NaNO3
Б) Продукт реакции при обычных условиях, либо при нагревании улетучивается.
Например, при действии концентрированной серной кислоты на кристаллический хлорид натрия, образуется газообразный хлороводород, а при действии соляной кислоты на сульфид железа(II) выделяется газ сероводород:
NaCl (тв) + H2SO4 (конц.)→Na2SO4+2HCl↑;
FeS+2HCl→FeCl2+H2S↑
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните предложенные задания:
Задание 1. Составьте уравнение химической реакции соляной кислоты и хлорида магния. Запишите уравнение реакции в молекулярной и ионной формах.
Задание 2. Составьте уравнение химической реакции взаимодействия серной кислоты с хлорида натрия. Запишите уравнение реакции в молекулярной и ионной формах.
3.Сформулируйте и запишите вывод о взаимодействии кислот с солями.
Вопросы для закрепления теоретического материала лабораторного занятия
В каких случаях возможно взаимодействие солей с кислотами?
Перечислите продукты реакции кислоты и соли.
Напишите уравнение химической реакции нитрата бария и соляной кислоты.
Приведите примеры взаимодействия кислоты и соли.
Напишите формулы карбоната натрия, сульфата лития, фосфата бария.
Лабораторное занятие №12
ИСПЫТАНИЯ РАСТВОРОВ ЩЕЛОЧЕЙ ИНДИКАТОРАМИ
Цель занятия: научиться проводить испытания растворов щелочей различными индикаторами.
Студент должен:
уметь: совершать лабораторные операции: взвешивание, отбор проб твердых и жидких веществ, приготовление раствора;
знать: правила техники безопасности при обращении с химическими реактивами, виды индикаторов;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: NаOH 1N р-р лакмус красный р-р микропробирки 3 шт, Fe CI3 1N р-р лакмус синий р-р, пробиркодержатель, NH4CI 1N р-р фенолфталеин сп. р-р, горелка спиртовая, CuSO4 1N р-р, метиловый оранжевый, сп. р-р.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Лакмусовая бумага является дешевым быстродействующим средством для определения кислой или основной среды.
Лакмусовая бумага получается путем нанесения лакмуса на обыкновенную пористую бумагу. Лакмус добывается непосредственно из определенного вида лишайников, которые являются симбиозом водорослей и грибков.
Лакмус бывает трех видов:
красный лакмус - используется для определения оснований;
синий лакмус - для кислот;
нейтральный лакмус - используется для определения как кислот, так и оснований.
Фенолфталеин является прозрачной жидкостью, которая остается бесцветной в кислой среде, и меняет свой цвет на малиновый - в щелочной.
Основное применение фенолфталеин нашел в процессах титрования, когда концентрация кислоты (основания) определяется путем реакции нейтрализации основанием (кислотой) известной концентрации.
Основания –это электролиты, которые диссоциируют на катионы и анионы гидроксильных групп.
Взаимодействие основания с солями. Эта реакция подчиняется общему правилу: взаимодействие между электролитами имеет место, если в результате образуется осадок, или газ, или малодиссоциирующее вещество (вода).
Нерастворимые гидроксиды металлов могут быть получены взаимодействием их солей с щелочами:
FeCl3 + 3NaOH = Fe (OH)3↓ + 3NaCl
Fe3+ + 3OH- = Fe (OH)3↓
Примером реакции между щелочью и солью, протекающей с образованием газа, может служить качественная реакция на соли аммония, т.е. качественная реакция на катион аммония:
NH4Cl + KOH = KCl + NH3↑ + H2O
NH4+ + OH- = NH3↑ + H2O
Выделяющийся аммиак обнаруживают либо по запаху, либо по посинению влажной красной лакмусовой бумажки, либо по появлению белого «дыма» при поднесении палочки, смоченной концентрированной соляной кислотой.
Разложение нерастворимых оснований. При нагревании нерастворимые основания и амфотерные гидроксиды разлагаются на соответствующий оксид металла и воду:
Cu(OH)2 = CuO +H2O
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия, выполните предложенные задания:
Задание 1. В три пробирки налейте по 5 капель раствора едкого натрия. Добавьте в первую пробирку 1-2 капли лакмуса красного, во вторую – 1- 2 капли фенолфталеина, в третью 1-2 капли метилового оранжевого. Что наблюдаете? Напишите уравнение диссоциации щелочи
Задание 2. Налейте в одну пробирку 4 капли раствора хлорного железа, во вторую пробирку – 4 капли хлорида аммония. В каждую из пробирок добавьте 4-6 капель раствора едкого натрия. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Задание 3. В пробирку налейте 4 капли раствора сульфата меди и добавьте 5-6 капель раствора едкого натрия до выпадения осадка. Что наблюдаете? Содержимое пробирки нагрейте в пламени горелки до изменений окраски осадка. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Гидроксид кальция Са(ОН)2 реагирует с веществом, формула которого:
а) H2SO4;
б) K2O;
в) NaCI;
г) NaOH.
Все основания реагируют:
а) с кислотами;
б) основными оксидами;
в) щелочами;
г) солями.
Гидроксид цинка Zn(OH)2 образуется при взаимодействии:
а) оксида цинка с водой;
б) оксида цинка с гидроксидом натрия;
в) хлорида цинка с гидроксидом железа (II);
г) растворов нитрата цинка и гидроксида натрия.
Общим свойством щелочей не является:
а) изменение окраски индикаторов;
б) взаимодействие с кислотными оксидами;
в) разложение при нагревании;
г) взаимодействие с кислотами.
Сокращённое ионное уравнение реакции водных растворов гидроксида лития и бромоводородной кислоты:
а) Li+ + HBr = LiOH + Br-;
б) OH- + HBr = H2O + Br-;
в) H+ + OH- = H2O;
г) Li+ + Вr- = LiBr.
Лабораторное занятие №13
ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С СОЛЯМИ
Цель занятия: изучить взаимодействие щелочей с солями.
Студент должен:
уметь: составлять уравнения химических реакций;
знать: химические свойства щелочей, солей; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Основания – электролиты диссоциирующие в воде на ионы металлов и гидроксогрупп.
Ca (OH)2 ↔ Ca2+ + 2OH-.
Основания бывают растворимые в воде (щелочи) и нерастворимые в воде.
Ca (OH)2 ↔ Ca2+ + 2OH-
Они называются основания гидроксидами: Ca (OH)2 – гидроксид кальция; Fe (OH)2 – гидроксид железа (II); Fe (OH)3 – гидроксид железа (III).
Химические свойства оснований.
1. Щелочи взаимодействуют:
- с кислотными оксидами 2NaOH + CO2 = Na2CO3 + H2O;
- с кислотами NaOH + HCl = NaCl + H2O;
- с солями, если образуется нерастворимое основание 2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓ 2.
Основания разлагаются при нагревании:
Zn (OH) 2↓ → ZnO + H2O.
Основания взаимодействуют с кислотами:
Zn (OH) 2↓ + 2HCl = ZnCl2 + 2H2O.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните задание:
В пробирку поместите 2 мл раствора соли FeCl3 и прилейте щелочи до образования осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
3.Сформулируйте и запишите вывод о взаимодействии щелочей с солями.
Вопросы для закрепления теоретического материала лабораторного занятия
Перечислите химические свойства щелочей.
Приведите три примера щелочей.
В каких случаях образуются нерастворимые основания?
Напишите реакцию взаимодействия гидроксида магния и карбоната меди.
Закончите реакцию: CuCl2+ NaOH = NaCl +?
Лабораторное занятие №14
РЕАКЦИЯ ЗАМЕЩЕНИЯ МЕДИ ЖЕЛЕЗОМ В РАСТВОРЕ МЕДНОГО КУПОРОСА
Лабораторное занятие №15
РЕАКЦИИ, ИДУЩИЕ С ОБРАЗОВАНИЕМ ОСАДКА, ГАЗА ИЛИ ВОДЫ
Лабораторное занятие №16
ЗАВИСИМОСТЬ СКОРОСТИ ВЗАИМОДЕЙСТВИЯ СОЛЯНОЙ КИСЛОТЫ С МЕТАЛЛАМИ ОТ ИХ ПРИРОДЫ
Лабораторное занятие №17
ЗАВИСИМОСТЬ ВЗАИМОДЕЙСТВИЯ ЦИНКА С СОЛЯНОЙ КИСЛОТОЙ ОТ ЕЕ КОНЦЕНТРАЦИИ
Лабораторное занятие №18
ЗАВИСИМОСТЬ СКОРОСТИ ВЗАИМОДЕЙСТВИЯ ОКСИДА МЕДИ (II) С СЕРНОЙ КИСЛОТОЙ ОТ ТЕМПЕРАТУРЫ
Цель занятий 14 – 18: изучить реакции замещения, присоединения, обмена.
Студент должен:
уметь: составлять уравнения химических реакций; проводить химические эксперименты; соблюдать технику безопасности при работе с химическими веществами;
знать: химические свойства щелочей, солей; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и материалы: растворы: медного купороса (CuSO4 · 5 H2O), BaCl2, H2SO4, NaOH, HCl, NaHCO3(хлебная сода), скрепка или кнопка, фенолфталеин, раствор азотной кислоты; раствор уксусной кислоты; раствор карбоната натрия; раствор нитрата серебра, раствор медного купороса, CuO (II) (порошок); пробирки, пипетки, спиртовка, штатив.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Существует несколько видов химических реакций. Самые распространенные:
реакции соединения;
реакции разложения;
реакции одинарного замещения.
1. Реакции соединения
В реакциях соединения хотя бы два элемента образуют один продукт:
2Na(т) + Cl2 (г) → 2NaCl(т) - образование поваренной соли.
Следует обратить внимание на существенный нюанс реакций соединения: в зависимости от условий протекания реакции или пропорций реагентов, вступающих в реакцию, - ее результатом могут быть разные продукты. Например, при нормальных условиях сгорания каменного угля получается углекислый газ: C(т) + O2 (г) → CO2 (г)
Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ: 2C(т) + O2 (г) → 2CO(г).
2. Реакции разложения
Эти реакции являются, как бы, противоположными по сути, реакциям соединения. В результате реакции разложения вещество распадается на два (3, 4...) более простых элемента (соединения):
2H2O(ж) → 2H2 (г) + O2 (г) - разложение воды
2H2O2 (ж) → 2H2 (г)O + O2 (г) - разложение перекиси водорода.
3. Реакции одинарного замещения
В результате реакций одинарного замещения, более активный элемент замещает в соединении менее активный:
Zn(т) + CuSO4 (р-р) → ZnSO4 (р-р) + Cu(т)
Цинк в растворе сульфата меди вытесняет менее активную медь, в результате чего образуется раствор сульфата цинка.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните задания:
Задание 1. Реакция замещения меди железом в растворе медного купороса Налейте в пробирку 2—3 мл раствора медного купороса (сульфата меди (II)) и опустите в него стальную кнопку или скрепку. Опишите свои наблюдения и уравнения реакции в молекулярном и ионном виде.
Задание 2. Реакции, идущие с образованием осадка, газа или воды В две пробирки прилейте по 1—2 мл раствора гидроксида натрия. Добавьте в каждую 2—3 капли раствора фенолфталеина. Затем прилейте в первую пробирку раствор азотной кислоты, а во вторую — раствор уксусной кислоты до исчезновения окраски. Что наблюдается после добавления фенолфталеина в пробирки? Запишите уравнение реакции в молекулярном и ионном виде.
В две пробирки прилейте по 2 мл раствора карбоната натрия, а затем добавьте: в первую — 1—2 мл раствора соляной кислоты, а в другую — 1—2 мл раствора уксусной кислоты. Запишите уравнение реакции в молекулярном и ионном виде.
К 1—2 мл соляной кислоты в пробирке добавьте несколько капель раствора нитрата серебра. Запишите уравнение реакции в молекулярном и ионном виде.
В две пробирки прилейте по 1 мл раствора медного купороса, а затем добавьте в каждую столько же раствора гидроксида натрия. Запишите уравнение реакции в молекулярном и ионном виде.
К 1 мл раствора серной кислоты в пробирке добавьте 5—10 капель раствора хлорида бария. Запишите уравнение реакции в молекулярном и ионном виде.
Задание 3. Изучение влияний на скорость химических реакций. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. В две пробирки поместите по одной грануле цинка. В одну прилейте 1 мл соляной кислоты (1:3), в другую – столько же этой кислоты другой концентрации (1:10). Укажите, в какой из пробирок реакция протекает более интенсивно. Запишите уравнение реакции в молекулярном и ионном виде.
Задание 4.Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. В 3 пробирки (подписанные, под номерами) прилить по 3 мл раствора НCl и внести в каждую из пробирок навески опилок одинаковой массы: в первую - Mg, во вторую - Zn, в третью – Fe. В какой пробирке реакция протекает быстрее? (или вообще не протекает)? Напишите уравнения реакций. Какой фактор влияет на скорость реакции?
Задание 5. Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры. В 3 пробирки (под номерами) налить по 3 мл раствора Н2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе; вторую - опустить в стакан с горячей водой; третью - нагреть в пламени спиртовки. В какой пробирке цвет раствора меняется быстрее (голубой цвет)? Что влияет на интенсивность реакции? Напишите уравнение реакции. Общий вывод:
Вопросы для закрепления теоретического материала лабораторного занятия
Что происходит после добавления фенолфталеина в раствор гидроксида натрия?
Что произойдет после добавления хлорида бария в раствор серной кислоты?
Как влияет на скорость химической реакции увеличение концентрации исходных веществ?
Перечислите факторы, влияющие на скорость химических реакций?
Приведите примеры взаимодействия металлов с кислотами при повышении температуры.
Лабораторное занятие №19
ВЗАИМОДЕЙСТВИЕ СОЛЕЙ С МЕТАЛЛАМИ, С СОЛЯМИ
Цель занятия: овладеть навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства солей.
Студент должен:
уметь: составлять уравнения химических реакций; проводить химические опыты;
знать: химические свойства солей; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и материалы: металлы Zn, Fe; растворы солей Pb(NO)3, CuSO4, Na2CO3, ZnSO4, BaCl2, KI, штатив с пробирками, индикаторы фенолфталеин и метиловый оранжевый.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Соли – электролиты диссоциирующие на ионы металла и кислотного остатка.
Ca (NO3)2 ↔ Ca2+ + 2NO- 3
Соли взаимодействуют:
- с солями, если образуется нерастворимая соль 3Na2S + 2FeCl3 = 6NaCl + Fe2S3↓
- с металлами, более активный металл вытесняет из раствора соли менее активный CuCl2 + Zn = ZnCl2 + Cu
- со щелочами 2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
- с более сильными кислотами, чем кислота, образующая соль FeS + 2HCl = H2S + FeCl2.
Гидролиз соли - это реакция взаимодействия соли с водой, в результате которой образуется ион слабого основания и меняется реакция среды раствора. Гидролизу подвергаются соли, в состав которых входит ион слабого электролита. Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза среда раствора соли станет щелочной и наоборот.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните задания:
Задание 1. Взаимодействие солей с металлами.
1.1. В пробирку поместите 2мл раствора соли Pb(NO3)2 и опустите гранулу цинка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
1.2. В пробирку поместите 2мл раствора соли CuSO4 и опустите немного железных опилок. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
Задание 2. Взаимодействие солей с солями.
2.1. В пробирку поместите 2мл раствора соли ZnSO4 и прилейте раствора соли BaCl2 до образования осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
2.2. В пробирку поместите 2мл раствора соли Pb(NO3)2 и прилейте раствора соли KI до образования осадка. Запишите наблюдения и химическую реакцию в молекулярном и ионном виде.
3. Гидролиз солей различного типа.
3.1.В две пробирки поместите по 2 мл раствора соли ZnSO4, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Укажите среду раствора соли и запишите химическую реакцию гидролиза соли.
3.2. В две пробирки поместите по 2 мл раствора соли Na2CO3, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Укажите среду раствора соли и запишите химическую реакцию гидролиза соли.
3.3. В две пробирки поместите по 2 мл раствора соли BaCl2, в одну добавьте каплю индикатора фенолфталеина, а в другую метилового оранжевого. Запишите наблюдения
3. Сформулируйте и запишите общий вывод.
Вопросы для закрепления теоретического материала лабораторного занятия
Какие соединения называются солями?
Запишите названия солей: ZnSO4; BaCl2.
Допишите предложение: Гидролизом соли называется?
Запишите формулы солей: сульфата меди (II); нитрата кальция.
Какие типы солей подвергаются гидролизу?
Лабораторное занятие №20
ПОЛУЧЕНИЕ, СОБИРАНИЕ И РАСПОЗНАВАНИЕ ГАЗОВ
Цель занятия: проверить правильность усвоения знаний о газообразных веществах, способах их получения и распознавания.
Студент должен:
уметь: составлять уравнения химических реакций; проводить химические опыты;
знать: химические свойства солей; принципы составления уравнений химических реакций;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и материалы: • гранулы цинка, серная кислота, хлорид цинка и азотная кислота; сульфит натрия и серная кислота; сульфат меди (II) и соляная кислота; карбонат калия и соляная кислота.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Углекислый газ или оксид углерода (IV) СО2 – бесцветный, не имеющий запах газ. Он примерно в полтора раза тяжелее воздуха. Растворим в воде. В лаборатории углекислый газ получают действием соляной кислоты на карбонат кальция:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑.
Распознание:
Помутнение известковой воды (продувание углекислого газа через известковую воду) СО2 + Са (ОН)2 = СаСО3 + Н2О;
Горящую лучину опустить в сосуд с углекислым газом. Лучина гаснет.
Водород (Н2) – самый легкий, бесцветный газ, не имеет запаха.
Вытеснением водорода металлами из растворов кислот: Zn + 2HCl = ZnCl2 + H2 ↑.
Кислород (О2) - без запаха и цвета, тяжелее воздуха, мало растворим в воде.
1.Разложением перманганата калия:
2KMnO4 = K2MnO4 + MnO2 + О2 ↑;
2.Разложением пероксида водорода:
2H2O2 = 2Н2О + О2 ↑
Распознание: Вспыхивание тлеющей лучинки, внесенной в сосуд с кислородом.
Аммиак (NН3) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха.
1.В промышленности: 3H2 + N2 = 2NH3;
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия и учебником, выполните задания:
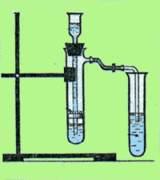
Задание 1: Получение, собирание и распознавание углекислого газа.
В химический стакан поместите кусочек мела (мрамора) и прилейте раствор соляной кислоты.
Через 1 мин внесите в стакан горящую лучинку. Что наблюдаете?
Заполните таблицу
| Название опыта |
|
| Что обозначают цифры на рисунке |
3 2 1 4 |
| Что делали |
|
| Что наблюдали |
|
| Уравнение реакции | Уравнение реакции получения оксида углерода (IY) запишите в молекулярном, полном ионном и сокращенном ионном виде. |
Задание 2. Получение, собирание и распознавание аммиака
Ход работы
В пробирку положите 1-2 мг хлорида аммония. 1-1 мг гидроксида кальция
Закрепите пробирку в держателе и осторожно нагрейте в пламени спиртовки. Что наблюдаете?
К отверстию пробирки влажную лакмусовую бумажку. Что наблюдаете?
Осторожно понюхайте выделяющийся газ. Что ощущаете?
| Название опыта |
|
| Что обозначают цифры на рисунке |
2 4 3 1 |
| Что делали |
|
| Что наблюдали |
|
| Уравнение реакции | Уравнение реакции получения аммиака запишите в молекулярном, полном ионном и сокращенном ионном виде. |
3. Сформулируйте и запишите общий вывод.
Вопросы для закрепления теоретического материала лабораторного занятия
Какие физические свойства углекислого газа вы наблюдали при проведении опыта?
Опишите способ собирания углекислого газа. Почему для собирания углекислого газа используется именно этот способ?
Составьте уравнение реакции взаимодействия оксида углерода (IY) с известковой водой в молекулярном, полном ионном и сокращенном ионном виде.
Опишите не менее двух способов распознавания аммиака.
Запишите уравнение реакции получения аммиака в лабораторных условиях: из гидроксида кальция и хлорида аммония в молекулярном и ионном виде.
Лабораторное занятие №21
ИЗГОТОВЛЕНИЕ МОДЕЛЕЙ МОЛЕКУЛ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Цель: закрепить теоретический материал о строении молекул органических веществ.
Студент должен:
уметь: изготавливать модели молекул первых гомологов предельных углеводородов и их галогенопроизводных; составлять структурные формулы изомеров органических веществ;
знать: названия органических веществ по систематической номенклатуре; понятия изомеров и гомологов;
иметь сформированные компетенции: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Обеспеченность занятия
Оборудование и инструменты: деревянные стержни, материал для лепки (пластилин), набор шаростержневых моделей.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Для построения моделей используйте детали готовых наборов или пластилин с палочками. Изготовьте шарики, имитирующие атомы углерода, их готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, - из светлой окраски, атомы хлора – из зеленого или синего цвета. Для соединения шариков используют палочки (спички, зубочистки). Написав формулу органического соединения, изготовьте его пространственную структуру, используя заранее приготовленные модели атомов и применяя знания о строении молекул предельных углеводородов (угол связи, длина связи, форма молекулы).
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните предложенные задания:
Задание 1. По формуле органического соединения напишите пространственную структуру:
А) нонана;
Б) декана;
В) гексана;
Г) октана.
Задание 2. Напишите структурные формулы всех возможных изомеров веществ:
пентана, гексана, этана, дихлорметана CH2Cl2, в соответствии с ними сделайте шаровидные модели изомеров на примере бутана и изобутана
Н Н H H
| | | |
Н – С – C – C – C – H
| | | |
Н Н H H
Н H H
| | | 
Н – С – C – C – H
| | |
H | H
H – C – H
|
H
Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Какие соединения называют предельными? Приведите 3 примера.
Какие темы теоретических занятий необходимо знать для выполнения данных практических заданий?
С помощью каких материалов можно изготовить пространственные структуры молекул органических соединений?
Какие виды номенклатур Вы знаете? Приведите по 2 примера названий соединений по каждой из номенклатур.
От каких факторов зависит длина связи, угол связи в строении молекул органических соединений?
Лабораторное занятие №22
ОЗНАКОМЛЕНИЕ С КОЛЛЕКЦИЕЙ ОБРАЗЦОВ НЕФТИ
Лабораторное занятие №23
ОЗНАКОМЛЕНИЕ С КОЛЛЕКЦИЕЙ ПРОДУКТОВ ПЕРЕРАБОТКИ НЕФТИ
Цель занятий 22-23: закрепить теоретические знания о нефтепродуктах.
Студент должен:
уметь: определять свойства органических соединений для выбора методов синтеза углеводородов;
знать: природные источники, способы получения и области применения органических соединений;
иметь сформированные компетенции: осуществлять поиск, анализ и оценку информации, необходимой для постановки и решения профессиональных задач, профессионального и личностного развития.
Обеспеченность занятия
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий, коллекции образцов нефти и продуктов нефтепереработки.
Краткие теоретические материалы по теме лабораторного занятия
Нефть – это маслянистая жидкость от желтого или светло-бурого до черного цвета с характерным неприятным запахом. Нефть легче воды и не растворима в ней. Она встречается во многих местах земного шара, пропитывая пористые горные породы на различной глубине.
Нефть – смесь газообразных, жидких и твердых углеводородов. Кроме углеводородов в нефти еще содержатся в небольшом количестве органические соединения, содержащие O, N, S и др. Имеются также высокомолекулярные соединения в виде смол и асфальтовых веществ (всего более 100 различных соединений).
Состав нефти еще зависит от месторождения. Но все они обычно содержат три вида углеводородов:
-парафины, в основном нормального соединения,
-циклопарафины,
-ароматические углеводороды.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните предложенные задания:
Задание 1. Рассмотрите выданную вам коллекцию. Письменно объясните, почему все нефтепродукты (кроме мазута) называют светлыми. Запишите формулы углеводородов, образующих фракции светлых нефтепродуктов. Какие физические процессы лежат в основе их получения?
Задание 2. Познакомьтесь со смазочными маслами, получаемыми перегонкой мазута. Какие процессы лежат в основе их получения?
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Как мировые цены на нефть влияют на бюджет нашей страны?
Предложите свои варианты уменьшения зависимости экономики России от колебаний мировых цен на нефть.
Как утечки нефти при ее добыче и транспортировке влияют на состояние экологии?
Приведите примеры последних сообщений из средств массовой информации о катастрофах, связанных с разливами нефти.
Как связана ваша будущая профессия с добычей и переработкой углеводородного сырья?
Лабораторное занятие №24
ОЗНАКОМЛЕНИЕ С КОЛЛЕКЦИЕЙ КАУЧУКОВ И ОБРАЗЦАМИ ИЗДЕЛИЙ ИЗ РЕЗИНЫ
Цель занятия: познакомиться с коллекциями каучуков и образцами изделий из резины.
Студент должен:
уметь: давать характеристику органическим соединениям;
знать: свойства каучуков;
иметь сформированные компетенции: осуществлять поиск, анализ и оценку информации, необходимой для постановки и решения профессиональных задач, профессионального и личностного развития.
Обеспеченность занятия
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий, коллекция каучуков и образов изделий из резины.
Краткие теоретические материалы по теме лабораторного занятия
Каучуки — это высокомолекулярные соединения, которые используются для получения резин, эбонитов и лаков, клеев, вяжущих веществ. Каучуки имеют линейное строение, обладают высокой эластичностью, широким диапазоном рабочих температур. При температуре 100° С они становятся хрупкими, а при температуре 200° С разжижаются.
Натуральный каучук (ПК) получают из млечного сока каучуконосных тропических растений. Сок обрабатывают кислотами и затем вальцуют образующийся продукт.
Синтетические каучуки (СК) получают полимеризацией непредельных соединений. В зависимости от вида исходного материала и условий их обработки изготавливают каучуки с различными свойствами и стойкостью.
Резина и эбонит — продукты вулканизации каучука. Ее проводят в присутствии веществ-вулканизаторов (часто серы, оксидов металлов) при повышенной температуре. В зависимости от количества введенного вулканизатора получают мягкую резину (2-Л % 8), полужесткую (12-20% 8) и жесткую резину (30-50% 8). Последняя носит название эбонит.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните предложенные задания:
Задание 1. Выданные вам образцы каучуков распределите на две группы – природные (натуральные) и синтетические.
Задание 2. Опишите свойства одного представителя каждого типа каучуков.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Какие вещества называют алкадиенами?
Дайте характеристику гомологического ряда алкадиенов согласно плану: а) общая формула; б) родовые суффиксы; в) виды изомерии; г) номенклатура; д) характерные реакции.
Какие виды каучуков вы знаете?
Перечислите химические и физические свойства резины.
В начале XIX в. в Англии стали модные плащи из водонепроницаемой ткани, называемые макинтошами. Это название они получили в честь английского химика и изобретателя Ч.Макинтоша, предложившего пропитывать плащевую ткань раствором натурального каучука. Однако на солнце такие плащи становились липкими, а в морозную погоду – ломкими. предложите свой способ устранения этих недостатков, повторив тем самым открытие другого выдающегося англичанина – Ч.Гудьира.
Лабораторное занятие №25
РАСТВОРЕНИЕ ГЛИЦЕРИНА В ВОДЕ И ВЗАИМОДЕЙСТВИЕ С ГИДРОКСИДОМ МЕДИ (II)
Цель занятия: исследовать свойства глицерина.
Студент должен:
уметь: проводить химические опыты с органическими соединениями;
знать: свойства глицерина, номенклатуру органических соединений;
иметь сформированные компетенции: анализировать, обобщать полученную информацию.
Обеспеченность занятия
Реактивы и оборудование: штатив с пробирками (3 шт.), глицерина, вода, гидроксид натрия, раствор сульфат меди (II).
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Спирты (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Соединения, в которых у одного атома углерода ![]() есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2 ® RCH=O + H2O
есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2 ® RCH=O + H2O
Спирты, содержащие три группы ОН у одного атома углерода 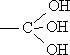 , не существуют.
, не существуют.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните опыты:
Опыт № 1. Растворение глицерина в воде.
Налейте в пробирку 1-2 мл глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды.
Опыт № 2. Взаимодействие глицерина с гидроксидом меди (II).
В пробирку налейте 1 мл раствора гидроксида натрия и добавьте немного раствора сульфата меди (II) до выпадения осадка. К осадку прилейте глицерин и взболтайте.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
Какие вещества называются спиртами?
Какой объём углекислого газа выделяется при сгорании 40 г этанола?
Перечислите химические свойства глицерина.
Дайте названия органическим соединениям по международной номенклатуре:
 а) СН3 – СН – СН – СН2 – СН3
а) СН3 – СН – СН – СН2 – СН3
ОН СН3

б) СН3 – СН2 – СН – СН – СН2 –СН2ОН
СН3 СН3
Лабораторное занятие №26
СВОЙСТВА УКСУСНОЙ КИСЛОТЫ, ОБЩИЕ СО СВОЙСТВАМИ МИНЕРАЛЬНЫХ КИСЛОТ
Цель занятия: изучить свойства карбоновых кислот.
Студент должен:
уметь: проводить химические опыты с органическими соединениями;
знать: свойства карбоновых кислот, номенклатуру органических соединений;
иметь сформированные компетенции: анализировать, обобщать полученную информацию.
Обеспеченность занятия
Оборудование и реактивы: штатив с пробирками (3 шт.), пробка с длинной стеклянной трубкой-холодильником, химический стакан, уксусная кислота (70%), магний, цинк, фенолфталеин, гидроксид натрия, этанол, серная кислота (конц.), вода, хлорид натрия.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните опыты:
Ход работы:
Опыт № 1. Взаимодействие уксусной кислоты с некоторыми металлами.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании).
Опыт № 2. Взаимодействие уксусной кислоты с основаниями.
Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты происходит обесцвечивание.
Опыт № 3. Взаимодействие уксусной кислоты со спиртами.
В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Как уксусная кислота реагирует с магнием и цинком?
Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнения всех этих трёх опытов.
Составьте уравнения реакций муравьиной кислоты:
а) с цинком;
б) с гидроксидом калия;
в) с водой.
Лабораторное занятие №27
ВЗАИМОДЕЙСТВИЕ ГЛЮКОЗЫ И САХАРОЗЫ С ГИДРОКСИДОМ МЕДИ (II)
Цель занятия: исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Студент должен:
уметь: проводить химические опыты с органическими соединениями;
знать: химические свойства, номенклатуру углеводов;
иметь сформированные компетенции: анализировать, обобщать полученную информацию.
Обеспеченность занятия
Оборудование и реактивы: металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, спиртовой раствор йода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5).
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Глюкоза С6Н12О6 – моносахарид, не гидролизующийся с образованием более простых углеводов.
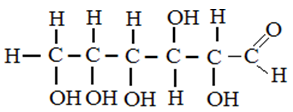
Глюкоза является одновременно многоатомным спиртом и альдегидом, то есть альдегидоспиртом. В водных растворах глюкоза может принимать циклическую форму.
Физические свойства
Глюкоза – бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. По сравнению со свекловичным сахаром менее сладкая.
она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
глюкоза есть в животных организмах;
в крови человека ее содержится примерно 0,1 %.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните опыты и задания:
Опыт 1. Внесите в пробирку 3 капли раствора глюкозы, одну каплю раствора соли меди и прибавьте при взбалтывании несколько капель гидроксида натрия до образования светло-синего раствора (щелочь должна быть в избытке). Что доказывает появление такой окраски раствора? Вспомните реакцию образования глицерата меди.
Полученный раствор нагрейте. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Опыт 2. Взаимодействие сахаров с гидроксидом меди (II).
Опыт проводят одновременно с растворами различных сахаров.
К 2 мл раствора сахара добавьте 1 мл разбавленного раствора щелочи и 3‑4 капли раствора сульфата меди (II). Встряхните пробирку и перемешайте содержимое пробирки стеклянной палочкой до растворения осадка. Жидкость при этом окрашивается в интенсивно-синий цвет.
Затем поместите все пробирки в нагретую водяную баню. Если сахар окисляется, то, вынув пробирку через 2-3 минуты, вы увидите изменения окраски и появление красного или коричневого осадка.
Заполните следующие таблицы:
Результаты опыта, проведенного при нормальных условиях
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
|
|
|
|
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при комнатной температуре.
На наличие каких функциональных групп указывает эта реакция?
Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при нагревании.
Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Перечислите химические свойства глюкозы.
Лабораторное занятие №28
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАХМАЛ
Цель занятия: исследовать химические свойства крахмала.
Студент должен:
уметь: использовать лабораторную посуду и оборудование; подбирать реактивы и аппаратуру;
знать: химические свойства крахмала; классификацию химических реакций и закономерности их протекания; назначение и правила использования лабораторного оборудования и аппаратуры;
иметь сформированные компетенции: организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
Обеспеченность занятия
Оборудование и реактивы: шпатель, крахмал, вода, пробирки, стакан, раствор йода.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторного занятия
Крахмал нативный или немодифицированный – пищевой продукт, который используется в домашней кулинарии и пищевой промышленности в качестве загустителя, стабилизатора, средства для капсулирования, наполнителя, носителя, покрытия.
Натуральными источниками вещества являются клубни и зерна растений.
Крахмалистыми продуктами являются:
зерновые – пшеница, кукуруза, рис, ячмень, рожь, сорго, пшено и другие;
корнеплоды – картофель, маниок, батат и другие;
бобовые – горох, нут, чечевица, маш и другие.
Наибольшее хозяйственное значение имеет картофельный, кукурузный, рисовый, пшеничный, тапиоковый крахмал. Изготавливается с помощью мокрого помола зерна и клубней.
Состав крахмала
Крахмалом называется углевод, полисахарид, состоящий из смеси амилозы и амилопектина. Это вещество синтезируется в растениях в виде зерен, которые имеют некоторые различия в структуре и свойствах в зависимости от вида растения. В состав крахмальных зерен входит также до 2% неуглеводных компонентов – белков, липидов, зольных элементов.
Свойства крахмала
Вещество представляет собой белый сыпучий порошок, не имеющий вкуса, при сжатии издающий характерный скрип.
Крахмалу свойственна хорошая растворимость в горячей воде. В холодной воде не растворяется.
Обладает свойствами клейстера или геля.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните опыты и задания:
Опыт 1. Отношение крахмала к воде.
В пробирку с 1 мл воды поместите на кончике шпателя сухого крахмала. Содержимое пробирки взболтайте. Растворяется ли крахмал в воде при комнатной температуре?
Содержимое пробирки порциями залейте при перемешивании в стакан с 5 мл горячей воды. При этом образуется крахмальный клейстер.
Задание: Отметьте наблюдения, происходящие в данном опыте. Сделайте вывод о растворимости крахмала в холодной и горячей воде.
Опыт 2. Взаимодействие крахмала с йодом.
В пробирку внесите 5-6 капель крахмального клейстера и одну каплю спиртового раствора йода. Что при этом наблюдается?
Задание: Отметьте наблюдения, происходящие в данном опыте. Объясните происходящие явления.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторного занятия
Почему крахмал растворяется в теплой воде?
В каких продуктах питания содержится крахмал?
Что происходит при добавлении раствора йода в крахмал?
Перечислите химические свойства крахмала.
К какому классу химических соединений относится крахмал? Назовите 3 других представителя того же ряда.
Лабораторное занятие №29
РАСТВОРЕНИЕ И ОСАЖДЕНИЕ БЕЛКОВ
Лабораторное занятие №30
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ
Цель занятий 29-30: закрепить теоретические знания о белках.
Студент должен:
уметь: сравнивать, анализировать, составлять уравнения реакций;
знать: свойства белков, отношение белков к нагреванию, кислотам, щелочам, цветные реакции на белки;
иметь сформированные компетенции: осуществлять поиск, анализ и оценку информации, необходимой для профессионального и личностного развития.
Обеспеченность занятия
Реактивы: водный раствор яичного белка, раствор сульфата аммония, серной кислоты, 20% раствор ацетата свинца, насыщенный раствор сульфата меди, азотная кислота (конц), раствор аммиака, 10%-ный раствор гидроксида натрия.
Раздаточные материалы: данные методические рекомендации по выполнению лабораторных заданий.
Краткие теоретические материалы по теме лабораторных занятий 29-30
Белки - высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Свойства белков:
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз - под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация - частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- высокой температуры.
- растворов кислот, щелочей и концентрированных растворов солей.
- растворов солей тяжёлых металлов.
- некоторых органических веществ (формальдегида, фенола).
- радиоактивного излучения.
Содержание отчёта по выполнению лабораторного задания
1. Напишите название, тему, цель лабораторного занятия.
2. Пользуясь кратким теоретическим материалом по теме лабораторного занятия выполните опыты:
Опыт 1. Свертывание белков.
а) Налейте в пробирку небольшое количество раствора белка и нагрейте в пламени горелки до кипения. Что наблюдаете?
б) В пробирку налейте 1 мл раствора белка и такое же количество сульфата аммония и смесь встряхните. Что происходит с белком? Что наблюдаете? Сделайте вывод о свойствах белка на основании этого опыта.
в) В две пробирки налейте по 1 мл раствора белка и медленно, по каплям, при встряхивании, доливайте, в одну из них, насыщенный раствор сульфата меди, а в другую - 20%-ный раствор ацетата свинца. Что наблюдаете?
Растворы разбавляют большим количеством воды. Сделайте вывод о действии тяжелых металлов на белок.
Опыт 2. Биуретовая реакция.
В пробирку по 1 мл раствора белка к 10% -ого раствора щелочи. Затем добавьте 2-3 капли раствора разбавленного сульфата меди, содержимое пробирки перемешайте. Что наблюдаете? Какой цвет раствора получили?
Опыт 3. Ксантопротеиновая реакция.
К 1мл раствора белка, налитого в пробирку, добавьте 5-6 капель концентрированной азотной кислоты. Что наблюдаете? Нагрейте содержимое пробирки. Что наблюдаете? Охладите смесь и добавьте к ней осторожно несколько капель концентрированного раствора аммиака. Как происходит переход окраски? Запишите наблюдения.
3.Сформулируйте и запишите вывод о проделанной работе.
Вопросы для закрепления теоретического материала лабораторных занятий 29-30
Какие соединения называются белками? Какое строение имеют белки? Как получают белки?
При каких условиях белки выпадают в осадок?
Что такое денатурация?
Какие реакции используются для обнаружения белков?
На наличие каких группировок в молекулах белка указывают цветные реакции на белки?
СПИСОК РЕКОМЕНДУЕМЫХ ИСТОЧНИКОВ
Габриелян О.С, Остроумов И.Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014.
Габриелян О.С, Остроумов И.Г., Остроумова Е.Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014.
Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей социально- экономического и гуманитарного профилей: учебник для студ. учреждений сред.проф. образования. — М., 2014.
Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М. Практикум: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О.С., Остроумов И.Г., Сладков С.А. Химия: пособие для подготовки к ЕГЭ: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О.С, Лысова Г.Г. Химия. Тесты, задачи и упражнения: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ. учреждений сред.проф. образования. — М., 2014.
Ерохин Ю.М. Химия: Задачи и упражнения: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М. Сборник тестовых заданий по химии: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю.М, Ковалева И.Б. Химия для профессий и специальностей технического профиля. Электронный учебно-методический комплекс. — М., 2014.
Сладков С. А, Остроумов И.Г., Габриелян О.С, Лукьянова Н.Н. Химия для профессий и специальностей технического профиля. Электронное приложение (электронное учебное издание) для студ. учреждений сред.проф. образования. — М., 2014.
| Версия: 1.0 | Без подписи документ действителен 8 часов после распечатки. Дата и время распечатки: 06.10.2014, 09:20 | Стр.3 из 44 |