

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до 24.06.2025
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Обобщающий урок по теме "Неметаллы"
Обобщающий урок построен по принципу состязания между командами. В работе 3 варианта работы. Количество вариантов можно увеличить засчет иных неметаллов.
Просмотр содержимого документа
«Обобщающий урок по теме "Неметаллы"»
Цель: обобщить и систематизировать знания учащихся по изученной теме; выявить уровень овладения системой знаний и умений, опытом деятельности.
Задачи урока:
-
обучающие: обобщить знания свойств неметаллов и их соединений, знание качественных реакций, закрепить умения составлять уравнения реакций в ионной и молекулярной форме, определять окислительно-восстановительные реакции и составлять для них электронный баланс; повышать интеллект учащихся, формировать умения систематизировать и анализировать информацию, полученную на уроках химии.
-
развивающие: развивать общеучебные умения и навыки (работы с учебником, обобщать), умение использовать свои знания для решения практических задач, навыки обращения с лабораторным оборудованием, умение работать в коллективе, где развиваются чувства доброжелательности и товарищества;
-
воспитательные: формировать условия для развития материалистического мировоззрения, формировать у учащихся чувство ответственности за выполненную работу.
Тип урока: обобщение и систематизация учебного материала с использованием информационно-коммуникационных технологий.
Вид урока: урок-состязание.
Оборудование:
-
Таблицы: Периодическая таблица химических элементов Д.И. Менделеева, таблица растворимости; пульт для работы с таблицей ХЭ.
-
Кристаллические решётки алмаза, графита, белого фосфора.
-
Мультимедиа
-
Раздаточный материал: маршрутные листы по теме «Неметаллы», тест «Неметаллы», таблица «Химические свойства неметаллов и их соединений», дифференцированные домашние задания (на карточках разного цвета), стихотворения для творческого задания.
-
Реактивы в лабораториях: раствор нитрата серебра, раствор соляной кислоты, в пробирках с номерами – растворы: 1 – хлорида натрия, 2 – сульфата натрия, 3 - карбоната натрия.
-
В лаборатории учителя: красный фосфор, бертолетовая соль, азотная кислота, порошок цинка, кристаллический йод, сера, бром, активированный уголь, графитовый карандаш.
-
Названия 3 групп: С, N, S.
Ход урока:
-
Организационный момент.
-
Актуализация учебного материала.
Как это ни странно, но сегодня мы попробуем объять необъятное – совместить в одном уроке такие разные предметы, как химию, литературу, историю. Известный писатель А.Е.Арбузов сказал: «Не могу представить себе химика, незнакомого с высотами поэзии, с картинами живописи, с хорошей музыкой. Вряд ли он создаст что-либо значительное в своей области».
-
Обобщение, систематизация, коррекция учебного материала.
1. Химическая разминка.
1 . Семен Исаакович Вольфкович (1896 – 1980) в одной из лабораторий Московского университета на Моховой получал это вещество в электрической печи при электротермической возгонке фосфоритов. Когда он поздно возвращался домой по почти не освещенным в то время улицам Москвы, его одежда излучала голубоватое свечение, а из–под ботинок высекались искры. Вскоре среди жителей Моховой улицы стали передаваться рассказы о “светящемся монахе”. Назовите вещество, которое получал Вольфкович.
(фосфор)
2. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около стола. В одной из бутылок находилась суспензия золы водорослей, а в другой – концентрированная серная кислота. Бутылки разбились и с пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде черно-фиолетовых кристаллов с металлическим блеском. Так был открыт новый элемент…
(йод)
2. Работа с периодической таблицей возле доски (4 учащихся): характеристика углерода, серы, азота и хлора по плану «Характеристика элемента». (Время на подготовку 7мин)
3. Работа с остальными учащимися класса (фронтальный опрос)
За каждый правильный ответ вы получаете баллы. По сумме набранных баллов в конце урока каждый из вас получит оценку.
3.1.Положение неметаллов в ПС.
- Где в ПС расположены неметаллы?
B
 неМе
неМе
At
- Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат.
3.2.Строение атомов неметаллов.
- Какое строение имеют атомы неметаллов?
| III A | IV A | V A | VI A | VII A | VIII A | ||||||||||||||||||
| B 1s22s22p1
2p1 | C 1s22s22p2
2p2 | N 1s22s22p3
2p3 | O 1s22s22p4
2p4 | F 1s22s22p5
2p5
| Ne 1s22s22p6
2p6 | ||||||||||||||||||
| 2s2 | ↑ |
|
| 2s2 | ↑ | ↑ |
| 2s2 | ↑ | ↑ | ↑ | 2s2 | ↑↓ | ↑ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ||||||||||||
3.3. -Что характерно для атомов неметаллов по сравнению с металалами?
Для атомов неметаллов, по сравнению с атомами металлов характерны:
* меньший атомный радиус;
* четыре и более электрона на внешнем энергетическом уровне.
3.4. -Какие свойства чаще всего проявляют неметаллы окислительные или восстановительные и почему?
-От чего это зависит?
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов оттягивать к себе общие электронные пары.
2.2. Ответы учащихся возле доски о характеристике элементов
4. Кристаллическое строение неметаллов - простых веществ. Аллотропия.(беседа)
4.1.-Какие типы кристаллические решетки встречаются у неметаллов?
Неметаллы имеют 2 типа кристаллических решёток:
- молекулярные (H2, O2, O3, N2, Cl2),
- атомные (алмаз, графит, кремний)
4.2.- Какие типы связей?
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь.
4.3. Что такое аллотропия? Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии - способность атомов одного химического элемента образовывать несколько простых веществ, а эти простые вещества называются аллотропными видоизменениями или модификациями.
4.4. В чем причины аллотропии?
 Причины аллотропии:
Причины аллотропии:

Образование молекул с разным Образование различных
числом атомов (кислород O2, озон O3) кристаллических форм (алмаз, графит),
разное строение кристаллических решёток
Р4 – белый фосфор – молекулярная К.Р.,
Р – красный фосфор – атомная К.Р.
5. Физические свойства неметаллов.

 Неметаллы
Неметаллы

В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
* газы – H2, O2, O3, N2, F2, Cl2;
* жидкость – Br2;
* твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода.
Температуры плавления у графита – 3800, у азота - -210 градусов.
6. Химические свойства неметаллов.
6.1.- Кем являются неметаллы в химических реакциях?
Неметаллы в химических реакциях могут быть и восстановителями, и окислителями.
Выводы:
1) Элементы-неметаллы расположены в главных подгруппах IV-VII групп ПС
Д.И. Менделеева, занимая её верхний правый угол.
2) На внешнем электронном слое атомов элементов-неметаллов находятся от 4 до 8 электронов.
3) Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
4) Высшие кислородные соединения неметаллов имеют кислотный характер.
5) Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
4. Тест-экспресс с взаимопроверкой
1 вариант – углерод,
2 вариант – сера,
3 вариант – азот,
1. Разновидности простого вещества, образованного одним и тем же элементом.
2. Электронная формула атома.
3. Количество электронов на внешнем энергетическом уровне.
4. Формула летучего водородного соединения.
5. Формула высшего оксида.
6. Масса 0,5 моль простого вещества.
7. Объём 2 моль газообразного оксида.
8. Высшая степень окисления элемента
9. Чего больше по массе в высшем оксиде: элемента или кислорода?
Ответы (на слайде)
«С» «S» «N»
1.аллотропные видоизм. 1. аллотропные видоизм. 1.аллотропия
2.1s22s22p2 2.1s22s22p63s23p4 2.1s22s22p3
3. 4 3. 6 3. 5
4.CH4 4.H2S 4.NH3
5.CO2 (12/44=0,27) 5.SO3 (32/80=0,4) 5.N2O5 (28/108=0,26)
6.6 г 6.16 г 6. 7 г
7.44,8л 7.44,8л 7. 44,8л
8.+4 8.+6 8. +5
9. кислорода 9. кислорода 9. кислорода
5. Химические свойства неметаллов и их соединений.
Задания для самостоятельной работы с учебником (по вариантам): вспомните и выпишите общие и отличительные свойства неметаллов и их соединений, напишите уравнения реакций, характеризующие химические свойства
оксидов на примере оксида серы(VI) SO3 – вариант 1 ;
кислот (типичные свойства) на примере азотной кислоты HNO3 – вариант 2 ;
солей на примере карбоната кальция CaCO3 – вариант 3 .
Одно из уравнений рассмотрите в свете ТЭД.
| Вещества | Общие свойства | Отличительные свойства |
| Простые вещества – неметаллы (фронтальная работа) |
|
|
| Кислотные оксиды – 1 группа |
|
|
| Кислоты – 2 группа |
|
|
| Соли – 3 группа |
| 1. При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов) |
Проверка заполнения таблицы производится учащимися самостоятельно, на экране – свойства неметаллов и их соединений.
6. Лабораторный практикум «А я опыты люблю».
Задание: Определить, в какой из пробирок находятся хлорид натрия, сульфат натрия, карбонат натрия.
| Реактивы | NaCl | Na2SO4 | Na2CO3 |
| AgNO3 |
| | |
| BaCl2 |
| | |
| HCl | | | |
- Проверка.
7. «Виртуальный эксперимент»
Команды смотрят видеосюжеты.
1. «Взаимодействие алюминия с йодом».
2. «Взаимодействие концентрированной азотной кислоты с углем».
После просмотра видеосюжетов по одному учащемуся от команды записывают уравнения реакций на доске и расставляют коэффициенты в уравнениях методом электронного баланса.
2Al + 3I2 = 2AlI3 + Q
- Определите тип реакции по всем изученным признакам (соединения, ОВР, экзотермическая, гетерогенная).
С + 4HNO3 (конц.) = 2Н2О + СО2 + 4NO2
3. Йодный вулкан (демонстрация) Смешивают 10 г мелко истёртого йода с 2,5 г цинковой пыли. Смесь высыпают горкой на керамическую плитку. В вершине делают углубление, в которое вносят 2-3 капли разбавленной соляной кислоты, накрывают колоколом. Горка воспламеняется, выделяются фиолетовые пары йода.
Zn + I2 = ZnI2 + Q
Выделяющаяся теплота способствует возгонке йода. Соляная кислота является инициатором реакции.
8. «Открытия».
1. В 1803 г. в лаборатории французского химика Клода Бертолле произошла занятная история. Один из учеников знаменитого химика обнаружил склянку с неизвестным красным порошком и спросил, как поступить с этим веществом? «Конечно, прежде всего, надлежит испытать его!» - воскликнул Бертолле. Ученик взял щепотку красного порошка и попытался растереть его с недавно полученной новой солью, получившей имя Бертолле. Лучше бы он этого не делал - в лаборатории раздался взрыв. Однако ученик не пострадал и смело продолжил испытания.
Внеся красный порошок в азотную кислоту, он отметил выделение красно-бурого газа; порошок при этом растворился.
Бертолле похвалил ученика: задание было выполнено правильно. Какое вещество находилось в склянке?
Ответ. Это был красный фосфор, который при контакте с хлоратом калия (бертолетова соль) и механическом воздействии (растирании) реагирует со взрывом:
6Р + 5КС1О3 = ЗР2О5 + 5КС1 (демонстрация)
Азотная кислота превращает красный фосфор в ортофосфорную кислоту, при этом выделяется газ NO2 - «лисий хвост»
Р + 5HNO3 (конц.) = Н3РО4 + 5NO2 + Н2О (демонстрация)
2. Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных названий. В 1772 г. шотландский химик, ботаник и врач Даниел Резерфорд назвал его «ядовитым воздухом». Английский химик Джозеф Пристли в том же году назвал его «дефлогистированным воздухом». В 1773 г. шведский химик-аптекарь Карл Вильгельм Шееле дал этому газу название «испорченный воздух». А английский химик Генри Кавендиш в 1774 г. назвал его «удушливый воздух». Наконец, в 1776 г. французский химик Антуан Лавуазье установил, что все названные выше газы - одно и то же вещество, и предложил свое название, в переводе с греческого означавшее «безжизненный воздух». Каково сейчас название этого неметалла?
Ответ. Это — неметалл азот. Название газообразному азоту дал Лавуазье
(от греч. а -частица «не» и zoe - «жизнь» (т.е. «азот», значит «безжизненный»).
- Дополнительный вопрос: в чём противоречие данного названия?
9. «Расчетный».
Вариант 1. Послушайте отрывок из романа «Затерянный мир» Артура Конан Дойла.
«Сейчас посмотрите, - сказал Челленджер. - Последние дни я напрягал все силы своего ума, чтобы разрешить задачу, как нам выбраться отсюда. Мы же убедились, что спуск по отвесным скалам невозможен, а туннеля больше не существует. Перебросить мост на утес нам, безусловно, не удастся. Что же тогда делать? Я как-то говорил нашему юному другу, что эти гейзеры выделяют водород в свободном состоянии. Отсюда логически вытекла мысль о воздушном шаре».
Рассчитайте, какая масса цинка потребовалась бы, чтобы наполнить шар объемом 1 кубический метр, которым воспользовались бы участники неудавшейся экспедиции.
Ответ.
Zn + 2HC1 = ZnCl2 + Н2↑,
n (H2) = 1000 (л) / 22,4 (л/моль) = 44,64 моль,
n (Zn) = n (H2) = 44,64 моль,
m (Zn) = 44,64 (моль) • 65 (г/моль) = 2901,6 г, или 2 кг 902 г.
Вариант 2. Послушайте отрывок из фантастического произведения А.Р.Беляева «Голова профессора Доуэля».
«Первый раз в жизни Артур Доуэль почувствовал, что не в состоянии овладеть чужой волей. Связанный, беспомощный, лежащий на полу человек издевался над ним. За дверью раздалось какое-то шипение. Доуэль продолжал петь все громче, но вдруг поперхнулся. Что-то раздражало его горло. Доуэль потянул носом и почувствовал запах. В горле и носоглотке неприятно щекотало, вскоре к этому присоединилась режущая боль в глазах. Запах усиливался. Доуэль похолодел. Он понял, что Равино отравил его хлором. Настал его смертный час. Затем свет погас, и Доуэль словно провалился... Очнулся он от свежего ветра, который трепал его волосы».
Рассчитайте, какой объем хлора потребуется для получения 1 кг поваренной соли.
Ответ.
2Na + С12 = 2NaCl,
n (NaCl) = 1000 (г) / 58,5 (г/моль) = 17,1 моль,
n (Cl2) = 1/2 • n (NaCl) = 8,55 моль,
V (C12) = 8,55 (моль) • 22,4 (л/моль) = 191,52 л.
8. «Творческий».
Я предлагаю вам стихотворение, которое отражает генетический ряд неметаллов. Вам необходимо это стихотворение перевести на язык химии и записать уравнения соответствующих реакций (для реакций ионного обмена следует составить полные и сокращенные ионные уравнения).
Пусть эти превращения
Дадут вам уравнения.
Красный фосфор я сжигаю,
К дымку воду приливаю.
Проверяю лакмусом,
Станет сразу красным он!
Добавим натрия гидроксид —
Цвет фиолетовый в колбе возник.
Потом получаю фосфат серебра,
Цветом - лимонная кожура.
Растворяю осадок желтый
Добавлением кислоты азотной.
И на доске превращения эти
Вы запишите, умные дети!
Ответ. Генетический ряд фосфора выглядит следующим образом:
Р → Р2О5 → Н3РО4 → Na3PO4 → Ag3PO4 → Н3РО4.
1) 4Р+5О2 = 2Р2О5
2) Р2О5 + 3Н2О = 2Н3РО4
3) 3NaOH + Н3РО4 = Na3PO4+ 3H2O
3Na+ + 3ОН- + 3Н+ + РО43- = 3Na+ + РО43- + 3H2O
ОН- +Н+=Н2О
4) Na3PO4 + 3 AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + РО43- +3 Ag+ + 3NO3- = Ag3PO4↓ + 3Na+ + 3NO3-
3 Ag+ + РО43- = Ag3PO4↓
5) Ag3PO4+ 3HNO3 = H3PO4+ 3AgNO3.
- демонстрация 1-3 реакций, 4 и 5 реакции учащиеся проводят самостоятельно.
-
Контроль ЗУН учащихся.
Тест по теме «Неметаллы»
1) Вставьте слова, пропущенные в тексте.
Атомы ………………. в отличие от атомов………………….. легко принимают наружные электроны, являются ……………………
2) Вставьте слова, пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах ………………………
В группах неметаллические свойства элементов …………………….
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?

4) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?
Азот +6
Хлор +5
Сера +4
Кремний +7
7) Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S —
2SO2 + O2 → 2SO3
S—
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно…..
а) 4 б) 5 в) 6 г) 7
9) Наиболее электроотрицательными являются атомы
а) серы
б) фосфора
в) кремния
г) хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
а) 2, 1
б) 2, 8, 2
в) 2, 8, 7
- Поменяйтесь тестом с товарищем и проверьте тест.
- Ответы – на экране.
-
Домашнее задание:
1. Создать собственный проект по теме «Неметаллы». Что это будет, решите вы сами: тезисы по уроку, план-конспект, стихотворение, рисунок, мини - сочинение, модель и т.д.
2. Для подготовки к контрольной работе я предлагаю вам дифференцированное задание (на карточках разного цвета):
1 уровень (красные карточки) - творческое задание:
Перевести стихотворение на язык химии и записать уравнения соответствующих реакций (для реакций ионного обмена составить полные и сокращенные ионные уравнения).
Бросим мы в костер бревно
И получим вещество.
В кислороде он горит —
Получается оксид.
А затем оксид другой,
Догадайтесь вот, какой?
Есть он в воздухе и в нас.
В лимонаде тот же газ.
Ну, а если мы прибавим
Гидроксида натрия,
То получим очень скоро
Соль такую знатную.
Станет пышным с ней пирог,
И подумать кто бы мог!
Разлагаем эту соль
Мы при нагревании.
В результате получаем
Соль с другим названием.
Сыпем кальция хлорид,
Видим изменения,
Белый порошок возник –
Признак без сомнения.
Растворяем в кислоте,
Видим пузырьки на дне,
Газ какой-то или что же,
Кто ответит верно мне?
Смело пишем на доске
Чудо превращения.
Классы нам веществ нужны –
Все без исключения.
Ответ. Генетический ряд углерода выглядит следующим образом:
С → СО → СО2 → NaHCO3 → Na2CO3
1)2С+О2=2СО
2) 2СО + О2 = 2СО2
3) СО2 + NaOH = NaHCO3
4) 2NaHCO3 = Na2CO3 + CO2 + H2O
5) Na2CO3 + CaCl2 = CaCО3 + 2NaCl
2Na+ + CO32- + Ca2+ + 2C1- = CaCO3 + 2Na+ + 2C1-
CO32- +Са2+ = СаСО3
6) CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества:
«С» С0 ← С2+ → С4+
«S» S2- ← S6+ → S4+
«N» N2+ ← N3- → N0
3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений:
«С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2
«S» S → H2S → SO2 → SO3 → H2SO4
«N» NH4Cl → NH3 → NO → NO2 → НNO3
-
Оценки за урок.
VII. Рефлексия.
Заканчивая урок, продолжите фразу: «Уходя с урока, я хочу сказать …»
-
Мне было комфортно на уроке.
-
Я много узнал нового.
-
Это мне пригодится в жизни.
-
Я приняла активное участие в обсуждении темы.
-
Мне это не интересно.
Я желаю вам хорошего настроения!
Общие и специфические свойства неметаллов и их соединений
| Вещества | Общие свойства | Отличительные свойства |
| Простые вещества – неметаллы
| - С металлами - С неметаллами
| - Галогены вытесняют друг друга с растворов солей. - Кислород реагирует со сложными веществами - Углерод реагирует с оксидами металлов - Углерод реагирует с углекислым газом - Кремний реагирует с растворами щелочей
|
| Кислотные оксиды | - С водой (кроме оксида кремния) - С основными оксидами - Со щелочами
| - Углекислый газ и оксид кремния реагируют с магнием - Оксид кремния реагирует с углеродом - Оксид кремния реагирует с солями, вытесняя более летучие оксиды
|
| Кислоты | - Изменяют окраску индикаторов - Реагируют с металлами - Реагируют с основными и амфотерными оксидами - С основаниями и амфотерными гидроксидами - С солями
| - Плавиковая (фтороводородная) кислота реагирует с оксидом кремния - Азотная и концентрированная серная кислоты по особому реагируют с металлами - При нагревании разлагаются азотная, угольная, кремниевая кислоты
|
| Соли | - С растворами солей - С кислотами - Со щелочами - С металлами
| - При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов)
|
Цель урока: систематизация, закрепление и обобщение знаний учащихся по заданной теме урока.
Задачи урока:
-
Образовательные: развивать навыки самостоятельной работы, умения работать с большим объемом информации, выбирать главное, применять полученные знания при выполнении заданий.
-
Развивающие: развитие мышления, совершенствование умственной деятельности.
-
Воспитательные: формирование творческого подхода к решению познавательных и практических задач, умения контролировать свою деятельность.
Данный урок проводится после изучения темы “Неметаллы” (по программе Л.С.Гузей) в 10 классе с применением “проникающей” технологии компьютерного обучения.
“Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь”. (А.Дистервег)
Оборудование.
-
Мультимедиа учебный курс “Общая и неорганическая химия”
-
Учебник Л.С.Гузей. Химия. 10класс. М.: Дрофа, 2002.
-
Таблица “Периодическая система химических элементов Д.И.Менделеева”
Ход урока
I. Организационный момент (объявление темы, цели и девиза урока)
II. Актуализация знаний. (эмоциональный настрой) - буквенный тест.
Задание: выберите букву, соответствующую правильному ответу, и прочтите фразу-напутствие на сегодняшний урок.
1.Где расположены химические элементы – неметаллы в периодической системе химических элементов Д.И. Менделеева:
У) в главных подгруппах;
Ф) в побочных подгруппах;
Х) в главных и побочных подгруппах?
2.Какая электронная формула отражает строение атома металла:
Г)…2s1
Д) …3s23p5
E) …4s2 3d3 ?
3.Какой из атомов неметаллов не может переходить в возбужденное состояние:
А) азот
Б) хлор
В) сера?
4. Молекула аллотропного видоизменения углерода – графита:
Х) одноатомна
Ц) многоатомна
Ч) полимерна ?
5. Какой вид химической связи в простых веществах, образованных атомами неметаллов:
Ж) ковалентная полярная
З) ионная
И) ковалентная неполярная ?
6. Какой тип кристаллической решетки у (Si)n:
А) молекулярная
Б) ионная
В) атомная?
7. Какую степень окисления имеет азот в соединении HNO3:
П) +3
Р) +5
С) -3?
8. Какой из перечисленных элементов обладает наиболее ярко выраженными окислительными свойствами:
А) кислород
Б) хлор
В) сера?
9. Как изменяется химическая активность неметаллов в периоде:
А) уменьшается
Б) увеличивается
В) не изменяется?
10.Как изменяются кислотные свойства водородных соединений неметаллов в ряду: NH3 – H2S – HCl :
Н) ослабевают
О) усиливаются
П) не изменяются?
11.Какой из перечисленных оксидов обладает наиболее ярко выраженными кислотными свойствами:
Р) Br2O7
C) I2O7
T) Cl2O7?
12. Какая из перечисленных кислот самая сильная:
Е) HClO4
Ж) H2SO4
З) HIO4?
13.С каким настроением Вы пришли на урок:
!) хорошим
.) плохим
?) отвратительным?
Обсуждаем результаты работы и делаем проверку через проектоскоп.
(Ответ: Удачи в работе!)
Отметьте на листе самоконтроля результаты выполнения буквенного теста.
III. Работа с мультимедиа CD-ROM “Общая и неорганическая химия”.
Предлагаю занять места у компьютеров и включиться в работу по выполнению план-задания .
Выдаются план-задания разного уровня сложности.
Выдаются листы самоконтроля и самооценки знаний (приложение 1)
План-задание №1.
Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
| № п/п | Этапы работы | Рекомендации |
| 1. | Повторите раздел “Азотная кислота”. | Обратите внимание на особенности взаимодействия азотной кислоты с металлами. |
| 2. | Повторите разделы “Химические свойства хлора”, “Кислородсодержащие кислоты хлора”. | Обратите внимание на взаимодействие хлора с холодным и горячим раствором щелочи. |
| 3. | Включите меню “тест”, режим – “прохождение теста”. |
|
| 4. | Выполните те задания теста, которые вы считаете более доступными для себя. | Пользуйтесь записями в тетради. Обсуждайте варианты ответов в парах. Следите за временем! |
| 5. | Отметьте на листе самоконтроля результаты тестирования. |
|
| 6. | Пройдите тест повторно, используя карточку-подсказку. | Делайте в тетради необходимые записи. |
| 7. | В листе самоконтроля выставьте итоговую отметку. |
|
План-задание №2.
Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
| № п/п | Этапы работы | Рекомендации |
| 1. | Выполните последовательно задания 1-10 теста. | Если испытываете затруднения, попробуйте “полистать” теорию. Следите за временем! |
| 2. | Отметьте на листе самоконтроля результаты тестирования. |
|
| 3. | Пройдите тест повторно, используя карточку-подсказку. | Делайте в тетради необходимые записи. |
| 4. | В листе самоконтроля выставьте итоговую отметку. |
|
План-задание №3.
Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
| № п/п | Этапы работы | Рекомендации |
| 1. | Включите меню “опыт” и выполните опыт №1. | Вспомните качественные реакции на ионы Fe3+, NH4+, Cl-, CO32- |
| 2. | Оцените результаты своей работы в листе самоконтроля. |
|
| 3. | Выполните последовательно все задания теста. | Пользуйтесь записями в тетради, теоретическим материалом электронного учебника. |
| 4. | Отметьте на листе самоконтроля результаты тестирования. |
|
| 5. | Пройдите тест повторно, используя карточку-подсказку. | Делайте в тетради необходимые записи. |
| 6. | В листе самоконтроля проставьте итоговую отметку. |
|
В ходе работы прерываемся на релаксационную паузу ( зарядка для глаз с цветовыми карточками) под музыку “Звуки природы”.
. Собираю листы самоконтроля и самооценки знаний.
IV. Домашнее задание: составить контрольную работу по теме “Неметаллы и их соединения”.
V. Рефлексия.
И, как всегда, уходя с урока, продолжите фразу: “Уходя с урока , я хочу сказать …”
Приложение 1.
Лист самоконтроля и самооценки знаний по теме “Неметаллы и их соединения”
ФИ учащегося ______________________
| № п/п | Задания | Количество ошибок | Оценка |
| 1. | Буквенный тест |
|
|
| 2. | Опыт №1 (для группы №3) |
|
|
| 3. | Контрольный тест |
|
|
| Итоговая отметка |
| ||
Приложение №2.
Карточка-подсказка.
1. С увеличением концентрации азотной кислоты восстановление идет в следующей последовательности: NH4NO3, N2, N2O, NO, NO2
2. Ответ № 2.
3.
| HCl + P4O10 | Cl2 + H2 | Cl2 + KOH | KClO3 + t |
| HCl + MnO2 | Cl2 + P4O6 | KClO3 + t | KClO4 + t |
4. FeSO4 • 7H2O
Красно-коричневый
Fe2O3
H2SO4
5. Вместо вопросов: 4, 2, MgCl2, SiH4, 4, 5, 2, N2, 6, H2O, 3, H2O, 6, NaCl, 3, CO2, 2
6. А – электролиз
B – H2
C – O2
D – H2O
E – CO2
F – Al2(SO4)3
7. Вместо вопросов: Cl2, HCl, NaOH, NaOCl, NaOH, H2O, NaOH, NaOH, H2O
8. Ответ № 2 и 4.
9. Na2O2, Na2O, NaN3
10. Вместо вопросов: Ca(ClO)2, H2O, Ca(ClO3)2, H2O, CaCl2
11. Ca2+, CaCO3, Mg2+, Mg(OH)2, MgO
12. CO2, 14CaO, 9Ca
Ответ № 3.
13. Ответ № 2.
Студент: Неметаллы – химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы – водород, азот, кислород, фтор, хлор и инертные газы, жидкость – бром, твердые тела – бор, углерод, кремний, фосфор, мышьяк, сера, селен, теллур, йод, астат.
Студент: Хлор относится к галогенам, это газ желто-зеленого цвета с резким запахом. При обычной температуре легко сжижается. Химически очень активен, токсичен. Применяется в производстве хлорсодержащих органических соединений, неорганических веществ, для отбелки целлюлозы и тканей, для санитарных нужд и обеззараживания воды.
Преподаватель химии: В первую мировую войну 22 апреля 1915 года хлор применили как оружие массового уничтожения на западном фронте недалеко от бельгийского города Ипра против англо-французских войск.
Вскоре для той же цели был применен другой удушающий газ – фосген – соединение хлора с оксидом углерода. В1917 году массовое применение нашел иприт, который тоже содержал хлор. К концу войны было разработано более 50 различных боевых отравляющих веществ, 95 % которых были производными хлора.
Преподаватель истории: Чтобы судить о действии отравляющих веществ на организм человека, достаточно указать, что в одной только английской армии, занимающей среди воюющих государств пятое место по численности, они вывели из строя с июля 1917г. по ноябрь 1918г. более 160 000 человек.
Преподаватель литературы: Послушайте отрывок из романа М.Шолохова “Тихий Дон”. “На рассвете 3 октября немцы, употребив удушливые газы, отравили три батальона 256-го полка и заняли первую линию наших окопов…
Валет, клацнув зубами, отпрыгнул, и на то место, где секунду назад стояли его ноги, спиленным деревом упал стоявший под сосной человек. Они перевернули его лицом вверх и тут только догадались, что под сосной нашел себе последний приют этот отравленный газами, бежавший от смерти, которую нес в своих легких, солдат одного из трех батальонов 256-го пехотного полка. Рослый, широкоплечий парень, он лежал, вольно откинув голову с лицом, измазанным при падении клейкой грязью, с изъеденными газом, разжиженными глазами, из стиснутых зубов его черным глянцевидным бруском торчал пухлый, мясистый язык.
Пойдем. Пойдем ради бога! Пусть он себе лежит, - шепнул товарищ, дергая Валета за руку.
Они пошли и сейчас же наткнулись на второй труп. Мертвые стали попадаться чаще. В нескольких метрах отравленные лежали копешками, иные застыли, сидя на корточках, некоторые стояли на четвереньках – будто паслись, а один, у самого хода сообщения, ведущего во вторую линию окопов, лежал, скрючившись калачиком, засунув в рот искусанную от муки руку”.
Преподаватель химии: А сейчас мы посмотрим фрагмент видеофильма об отравляющих веществах.
Преподаватель химии: Академик Н. Д, Зелинский, выдающийся химик, изобрел противогаз, действующий по принципу адсорбции. Это произошло в 1915 г. Использование угольного противогаза целиком освобождало вдыхаемый воздух от ядовитых примесей.
Студент: Древесный уголь – твердый, пористый, высокоуглеродистый продукт, образующийся при пиролизе древесины. Пиролиз – это получение древесного угля. При этом древесину нагревают без доступа воздуха. В результате ее разложения образуется уголь, горючий газ, в состав которого входят метан и другие продукты. Применяется в производстве кристаллического кремния, сероуглерода, активного угля, а также как топливо в быту. Древесный уголь при обычных условиях поглощает различные газы и растворенные вещества.
Преподаватель химии: В настоящее время древесный уголь, сохранивший в былых войнах миллионы людей от ужасных мучений и смерти, в знак благодарности демонстрируется на музейных стендах.
Преподаватель литературы: Я прочитаю вам отрывок из произведения Э. М. Ремарка “На западном фронте без перемен”.
“ Глухие хлопки химических снарядов смешивались с грохотом взрывов. Между разрывами слышно гудение набатного колокола: гонги и металлические трещотки возвещают далеко вокруг: “Газ, газ, газ!”.
В эти первые минуты решается вопрос жизни и смерти: герметична ли маска?
Я помню страшные картины в лазарете: отравленные газом, которые еще несколько долгих дней умирают от удушья и рвоты, по кусочкам отхаркивая перегоревшие легкие.
Я дышу осторожно, прижав губы к клапану…
Моя голова в противогазе звенит и гудит, она, кажется, вот-вот лопнет. Легкие работают с большой нагрузкой, им приходится вдыхать все тот самый горячий, уже не раз побывавший в них воздух, вены на висках вздуваются. Еще немного, и я, наверно, задохнусь.
…Ветер разогнал газ, воздух чист. Тогда и я тоже с хрипом срываю с себя маску и падаю. Воздух хлынул мне в грудь, как холодная вода, глаза вылезают из орбит, какая-то темная волна захлестывает меня и гасит сознание”.
В этом же романе говорится о том, что отравляющий газ особенно долго держится у земли. “Увидав наверху людей без противогазов, они (солдаты в воронке) тоже сняли свои маски и успели глотнуть достаточно газа, чтобы сжечь себе легкие. Сейчас их состояние безнадежно, они умирают медленной, мучительной смертью от кровохарканья и приступов удушья”.
Студент: Сера – химический элемент, желтые кристаллы. Устойчива в двух модификациях – ромбической и многоклинной. В воде нерастворима. Серу выплавляют из самородных руд, получают также окислением кислородом воздуха сероводорода, содержащегося в природном нефтяном, кокосовом газах. Около 50% серы идет на производство серной кислоты, 25% - на получение сульфидов, остальная - для борьбы с болезнями растений, вулканизации, производства спичек.
Преподаватель литературы: Константин Паустовский в одном из своих рассказов описывает, как белогвардейцы пытались уничтожить партизан, скрывавшихся в керченских каменоломнях. Заливая по трубам в шахты серную кислоту, они вызывали реакцию выделения углекислого газа, который при концентрации свыше 4% вызывает отравление, нарушение двигательных и речевых функций, а при концентрации свыше 10% - смерть от паралича дыхательного центра.
Студент: Фосфор – от греческого phosphorus – светоносный. Образует несколько модификаций – белый, красный и др. Белый фосфор легко самовоспламеняется, светится в темноте, ядовит. Красный фосфор менее активен химически, ядовит. Добывается из апатитов и фосфоритов. Главный потребитель - сельское хозяйство. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных.
Преподаватель химии: Специальными опытами было установлено, что кусочки фосфора загораются на воздухе при 40о С, а порошок, образующийся после испарения растворителей, - при 0о С. Это свойство фосфора и привлекло внимание военных.
Преподаватель истории: Во время второй мировой войны немцы применили против англичан “бомбы-листочки” для поджигания хлебов на корню, сельских построек, лесов. Такие же бесшумные диверсионные устройства сбрасывались на мирные города и села Кореи, Индонезии, Кубы.
Вся бомба представляет собой целлулоидную пластинку размером 10х15 см2, в центре которой укреплена таблетка белого фосфора, покрытая мокрой ватой. Хранят и перевозят их в банках с водой. Во время падения вода испаряется, и “бомба” загорается. Горение продолжается около одной минуты.
Раствор белого фосфора в сероуглероде и скипидаре применяется в огнеметах.
На вооружении американской армии имеются фосфорные снаряды, содержащие до 7 кг белого фосфора, и дымовые мины с таким же зарядом.
Во время второй мировой войны использовались зажигательные бутылки (раствор белого фосфора в сероуглероде). Подобные бутылки использовались в Анголе и Южном Вьетнаме.
Преподаватель литературы: В “Повести временных лет” - летописном своде событий, составленном в Киеве, - описание похода князя Игоря заканчивается словами очевидцев: “Словно молнию…которая на небе, греки имеют у себя и пускали ее сжигая нас, поэтому мы и не одолели их”. Дружинники князя защищались от “греческого огня” мокрыми воловьими шкурами, кожаными щитами, но терпели поражение. Горящая смесь выбрасывалась греками через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси греки держали в тайне.
Преподаватель химии: Предполагают, что в нее входили сера, нефть, горючие масла, смола, селитра, клей и вещества для окраски пламени. Погасить этот состав водой было трудно.
Преподаватель литературы: А теперь, ребята, давайте вернемся к вашим технологическим картам, которые лежат на столах у каждой группы и в которые занесены вопросы для изучения, рассмотренные на сегодняшнем уроке. Проверьте, все ли мы их разобрали. Вторым пунктом в технологической карте стоят задания по созданию проекта. Т.е. каждой группе необходимо создать свой собственный небольшой проект на одну из тем, предложенных вам в карте. Что это будет, решите вы сами: тезисы по уроку, план-конспект, стихотворение, рисунок, мини-сочинение, модель и т.д. В столах вы найдете необходимые инструменты для создания проекта: бумагу, карандаши, фломастеры, пластилин, спички. Пожалуйста преступайте, но не забывайте о защите своего проекта. (Студенты работают над заданием)Обсуждение проектов.
Преподаватель химии: Итак, ребята, наш урок заканчивается и я хочу отметить, что вы все сегодня замечательно поработали. Я говорю вам всем спасибо. Но мы забыли самое главное – поблагодарить ребят, которые подготовили для вас сегодняшнее занятие. Позвольте их представить. (Представление участников).
Преподаватель литературы: Сегодняшний урок прошел в нетрадиционной форме, и нам хочется узнать, понравился ли он вам. Поэтому в заключении каждый из вас должен выразить свое отношение к сегодняшнему уроку. Для этого вам необходимо выбрать один цвет из тех карточек, которые у вас в руках и сдать их мне.
А домашним заданием будет следующее: написать научно-фантастический рассказ с использованием прозвучавших на уроке терминов.
Маршрутный лист
Тема: Неметаллы. Общая характеристика неметаллов.
Условные обозначения: Словарь
ПС – периодическая система 1. Окислительные свойства
е – электрон 2. Электроотрицательность
неМе – неметалл 3. Аллотропия
Э.О. – электроотрицательность 4. Аллотропные видоизменения
А. – аллотропия (модификации)
Х.р. – химическая реакция
-
Положение неметаллов в ПС.
B
 неМе
неМе
At
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат.
-
Строение атомов неметаллов.
| III A | IV A | V A | VI A | VII A | VIII A | ||||||||||||||||||
| B 1s22s22p1
2p1 | C 1s22s22p2
2p2 | N 1s22s22p3
2p3 | O 1s22s22p4
2p4 | F 1s22s22p5
2p5
| Ne 1s22s22p6
2p6 | ||||||||||||||||||
| 2s2 | ↑ |
|
| 2s2 | ↑ | ↑ |
| 2s2 | ↑ | ↑ | ↑ | 2s2 | ↑↓ | ↑ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ||||||||||||
Для атомов неметаллов, по сравнению с атомами металлов характерны:
* меньший атомный радиус;
* четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
* газы – H2, O2, O3, N2, F2, Cl2;
* жидкость – Br2;
* твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
 Причины А:
Причины А:

Образование молекул с разным Образование различных
числом атомов (кислород, озон) кристаллических форм (алмаз, графит)
4. Физические свойства неметаллов.

 Неметаллы
Неметаллы

5. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
6. Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
-4 -3 -2 -1
RH4 → RH3 → H2R → HR
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
NH3 → H2O → HCl
осн. амф. кисл.
H
 Cl + H2O [ H3O ]+ +Cl-
Cl + H2O [ H3O ]+ +Cl-
N
 H3 + H2O NH4++OH-
H3 + H2O NH4++OH-
2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
Выводы:
1) Элементы-неметаллы расположены в главных подгруппах ….. ….. ПС Д.И. Менделеева, занимая её верхний правый угол.
2) На внешнем электронном слое атомов элементов-неметаллов находятся от … до… электронов.
3) Неметаллические свойства элементов ………….. в периодах и ………….. в подгруппах с увеличением порядкового номера элемента.
4) Высшие кислородные соединения неметаллов имеют ………….. характер (кислотные оксиды и гидроксиды).
5) Атомы элементов-неметаллов способны как ………… электроны, проявляя окислительные функции, так и ………….. их, проявляя восстановительные функции.
ТЕСТ
1) Вставьте слова, пропущенные в тексте.
Атомы ……… в отличие от атомов……. легко принимают наружные электроны, являются …….
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах …..
В группах неметаллические свойства элементов ………
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?

4 ) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?
Азот +6
Хлор +5
Сера +4
Кремний +7
7) Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S —
2SO2 + O2 → 2SO3
S—
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно…..
а) 4 б) 5 в) 6 г)7
9) Наиболее электроотрицательными являются атомы…..
• серы
• фосфора
• кремния
• хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
• 2, 1
• 2, 8, 2
• 2, 8, 7
Поменяйтесь тестом с соседом и проверьте тест.
2. Вопросы разминки.
Первой группе:
М.В. Ломоносов в статье, опубликованной в 1745 г., писал: “При растворении какого-либо неблагородного металла, особенно железа, в кислотах из отверстия склянки вырывается горючий пар”. Что это за вещество?
Второй группе:
Семен Исаакович Вольфкович (1896 – 1980) в одной из лабораторий Московского университета на Моховой получал это вещество в электрической печи при электротермической возгонки фосфоритов. Когда он поздно возвращался домой по почти не освещенным в то время улицам Москвы, его одежда излучала голубоватое свечение, а из–под ботинок высекались искры. Вскоре среди жителей Моховой улицы стали передаваться рассказы о “светящемся монахе”. Назовите вещество, которое получал Вольфкович
Третьей группе:
Шведский химик так описал один свой опыт, выполненный в 1774 г.: “Я поместил смесь черной магнезии (оксид марганца) с муриевой кислотой (соляной) в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом. Газ имел желто-зеленный цвет, пронзительный запах”. Назовите этот газ.
Четвертой группе:
У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа часто обедал в лаборатории. В один из дней во время обеда кот, чего-то испугавшись, прыгнул на пол, но попал на бутылки, стоявшие около стола. В одной из бутылок находилась суспензия золы водорослей, а в другой – концентрированная серная кислота. Бутылки разбились и с пола стали подниматься клубы сине-фиолетового пара, которые оседали на окружающих предметах в виде черно-фиолетовых кристаллов с металлическим блеском. Так был открыт новый элемент…
2. Задания для работы с учебником – на работу 5–10 минут, отчеты групп – устно, на доске – уравнения (примеры реакций, характеризующие свойства), остальные на листах заполняют таблицу:
| Вещества | Общие свойства | Отличительные свойства |
| Простые вещества – неметаллы |
|
|
| Оксиды |
|
|
| Кислоты |
|
|
| Соли |
|
|
Задания для работы с учебником:
-
Выписать химические общие и специфические свойства неметаллов
-
Выписать химические общие и специфические свойства кислотных оксидов неметаллов
-
Выписать химические общие и специфические свойства кислот
-
Выписать химические общие и специфические свойства солей
Проверка заполнения таблицы производится учащимися самостоятельно, на экране высвечиваются свойства (слайды 7–12, приложение 3)
-
Лабораторная работа.
Определить в какой из пробирок находятся иодид калия, хлорид калия, карбонат калия. На листах записываются – уравнения реакций. Проверка осуществляется самостоятельно (слайды 13–17, приложение 3).
-
Самостоятельная работа.
Каждый учащийся составляет уравнения реакций в соответствии с цепочкой превращения, одно уравнение нужно записать в ионном виде, одно с электронным балансом (слайд 18, приложение 3). В каждой группе учащиеся получают разные варианты цепочек.
-
Определение и инструктаж домашнего задания.
Домашнее задание: повторить параграф 24, доказать качественный состав соли хлорид аммония – 1 вариант, сульфат аммония – 2 вариант (слайд 19, приложение 3)
-
. Итог урока. Выставление отметок за работу групп (слайд 20, приложение 3)
При оценивании за ответы выставляются баллы, которые в конце урока переводятся в отметки.
Критерии для оценивания ответов
| Критерии для оценивания ответов | Баллы |
| 1. Устный полный ответ | 2 |
| 2. Неполный устный ответ | 1 |
| 3. Молекулярное уравнение, составленное без ошибок | 2 |
| 4. Молекулярное уравнение, составленное с одной или двумя ошибками (неверно поставлен индекс или коэффициент) | 1 |
| 5. Ионное уравнение, составленное без ошибок | 3 |
| 6. Ионное уравнение, составленное с 1 или 2 ошибками (не написан или неверно записан заряд, индекс, коэффициент) | 2 |
| 7. Ионное уравнение, составленное с 3 или 4 ошибками (не написан или неверно записан заряд, индекс, коэффициент) | 1 |
| 8. Правильно определены все степени окисления | 2 |
| 9. При определении степеней окисления допущена 1 или 2 ошибки | 1 |
| 10. При составлении электронного баланса правильно определено количество отданных и принятых электронов | 1 |
| 11. Правильно определены окислители и восстановители | 1 |
| 12. При выполнении опыта соблюдение всех требований техники безопасности и правил обращения с оборудованием | 2 |
| 13. Правильная формулировка вывода | 2 |
| 14. Неудачная формулировка вывода | 1 |
| 15. Недостатки в оформлении | - 1 |
Пример индивидуального листа опроса для заполнения учащимися
Индивидуальный лист опроса
Фамилия ___________________________________
Группа_____________________________________
Задание № 1: название вещества _______________
Задание № 2: при подготовке ответа заполнить таблицу:
| Вещества | Общие свойства | Отличительные свойства |
| Простые вещества – неметаллы | 1.
2. | 1.
2.
3.
4.
5. |
| Оксиды (кислотные) | 1.
2.
3. | 1.
2.
3. |
| Кислоты | 1.
2.
3.
4.
5. | 1.
2.
3.
4.
5. |
| Соли | 1.
2.
3. | 1.
2. |
Задание № 3. Лабораторная работа
Определить - в какой из пробирок находятся: хлорид натрия, иодид калия, карбонат натрия. Уравнения записать в молекулярной и ионной форме. Оформить результаты в виде таблицы:
| Порядок выполнения | Что делал? | Что наблюдал? | Выводы. Уравнения реакций |
|
| | | |
|
| | | |
|
| | | |
Задание № 4
Составить уравнения в соответствии с цепочкой превращения.
Уравнения, обозначенное цифрой 1 записать в ионном виде, а обозначенное цифрой 2 – с электронным балансом.
1 2
NH4Cl ![]() NH3
NH3 ![]() NO
NO![]() NO2
NO2
Жить - значит узнавать.
Д.И.Менделеев
Знать - значит победить!
А.Н.Несмеянов
Просто знать — еще не все,
знания надо уметь использовать.
И.В.Гете
I. Конкурс «Викторина».
1. Один из этих двух элементов в виде простого вещества хорошо горит, другой - поддерживает горение, а соединение, состоящее из этих элементов, пригодно для тушения огня.
(Водород и кислород, которые вместе образуют воду.)
2. Аллотропное видоизменение какого элемента пахнет чесноком?
(Белый фосфор.)
3. Какое простое вещество-неметалл издавна включали в состав мазей для лечения кожных заболеваний?
(Сера.)
4. В атмосфере какого газа-неметалла хранят старинные рукописи?
(Азот.)
5. Это простое вещество используют для очистки воды и воздуха от нежелательных примесей, для удаления сивушных масел из спирта.
(Активированный уголь.)
6. Каким элементом богата морская капуста - ламинария?
(Йод.)
7. Из этого вещества при высоких температуре и давлении получают искусственные алмазы.
(Графит.)
8. Какое простое вещество обладает способностью светиться в темноте?
(Белый фосфор.)
9. Без этого элемента немыслима жизнь на Земле, ему обязана своим существованием органическая химия, в природе он существует в виде нескольких аллотропных модификаций, из них наиболее известные -три. О каком элементе идет речь?
(Углерод.)
10. Образованное этим элементом простое вещество оказывает сильное раздражающее действие на слизистую оболочку глаз и дыхательную систему. О каком веществе идет речь?
(Хлор.)
11. Этот неметалл издавна употребляли для изготовления лекарственных препаратов, чернения оружия, приготовления черного пороха, в производстве спичек; оксид этого неметалла - для отбеливания тканей. О каком неметалле идет речь?
(Сера.)
12. Второй элемент по распространенности в земной коре, в свободном виде в природе не встречается, его соединения входят в состав растительных и животных клеток, некоторые организмы обладают способностью его накапливать. Что это за элемент?
(Кремний.)
13. Впервые этот неметалл выделил Г.Кавендиш. В переводе с греческого его название означает «недеятельный», «неработающий». Что это за неметалл?
(Инертный газ аргон.)
14. Этот газ нашел применение в рекламной индустрии, заполненные им стеклянные трубки дают ярко-красное свечение. Название этого газа в переводе с греческого означает «новый». Что это за газ?
(Неон.)
15. Первенство открытия этого химического элемента принадлежит китайскому ученому VIII в. Мао Хао, который за 1000 лет до А.Л.Лавуазье установил, что в состав воздуха входит газ, поддерживающий горение и дыхание. О каком газе идет речь?
(Кислород.)
16. Эту аллотропную модификацию серы можно получить в виде нитей.
(Пластическая сера.)
17. Этот неметалл считается самым активным среди всех неметаллов.
(Фтор.)
18. Какой химический элемент называют «элементом жизни и мысли»?
(Фосфор.)
19. Недостаток этого элемента в организме человека приводит к кариесу зубов.
(Фтор.)
20. Какого элемента больше всего на Земле, а какого в космосе?
(На Земле больше всего кислорода, в космосе — водорода.)
II. Конкурс «Виртуальный эксперимент».
1. Команды смотрят видеосюжеты. «Взаимодействие концентрированной азотной кислоты с фосфором».
«Взаимодействие концентрированной азотной кислоты с углем».
После просмотра видеосюжетов по одному учащемуся от команды записывают уравнения на доске и расставляют коэффициенты в уравнениях методом электронного баланса.
Ответ. Уравнения с коэффициентами выглядят так:
Р + 5HNO3 (конц.) = Н3РО4 + 5NO2 + Н2О
С + 4HNO, (конц.) = 2Н2О + СО, + 4NO,.
2. Команды смотрят видеофрагмент «Горение белого фосфора». Учащиеся записывают в тетрадях уравнение реакции, а затем комментируют эту реакцию.
Ответ. 4Р + 502 = 2Р2О5.
III. Конкурс «Открытия».
1. В 1803 г. в лаборатории французского химика Клода Бертолле произошла занятная история. Один из учеников знаменитого химика обнаружил склянку с неизвестным красным порошком и спросил, как поступить с этим веществом? «Конечно, прежде всего, надлежит испытать его!» - воскликнул Бертолле. Ученик взял щепотку красного порошка и попытался растереть его с недавно полученной новой солью, получившей имя Бертолле. Лучше бы он этого не делал - в лаборатории раздался взрыв. Однако ученик не пострадал и смело продолжил испытания.
Внеся красный порошок в азотную кислоту, он отметил выделение красно-бурого газа; порошок при этом растворился. При поджигании красного порошка появилось пламя, а потом — белый дым. Бертолле похвалил ученика: задание было выполнено правильно. Какое вещество находилось в склянке?
Ответ. Это был красный фосфор, который при контакте с хлоратом калия (бертолетова соль) и механическом воздействии (растирании) реагирует со взрывом:
6Р + 5КС1О3 = ЗР2О5 + 5КС1.
Азотная кислота превращает красный фосфор в ортофосфорную кислоту, а на воздухе он горит, превращаясь в белый «дым» — частички оксида фосфора(V), который гигроскопичен и мгновенно реагирует с влагой воздуха с образованием мельчайших капелек ортофосфорной кислоты:
Р + 5HNO3 (конц.) = Н3РО4 + 5NO2 + Н2О,
4Р + 5О2 = 2Р2О5,
Р2О5 + ЗН2О = 2Н3РО4.
2. Студент Гейдельбергского университета Карл Левиг в 1825 г. изучал воды минеральных источников Германии. Одна из приготовленных им проб воды обладала интересной особенностью - она желтела под действием хлора. Левиг извлек неизвестное вещество, придававшее желтоватый цвет воде, с помощью диэтилового эфира, а после испарения эфира обнаружил красно-бурую жидкость с резким неприятным запахом. Студент уже собирался опубликовать результаты своих опытов, но научный руководитель посоветовал повременить, чтобы иметь возможность детально исследовать новое вещество.
Но именно в это время 23-летний химик Антуан Балар из Франции получил то же самое вещество и сразу отправил его образец в Парижскую академию наук. Известные химики Жозеф Гей-Люссак и Луи Тенар подтвердили открытие нового элемента (Балар назвал его «муридом»), но переменили название на другое - bromos, которое в переводе с греческого означает «зловоние». О каком веществе идет речь?
Ответ. Левиг и Балар открыли бром. Воды некоторых соляных болот и озер содержат бромид натрия, из которого при обработке хлором выделяется бром:
2NaBr + С12 = 2NaCl + Br2
3. В начале 1915 г. около городка Ипр на западе Фландрии (Бельгия) впервые был использован отравляющий газ. Он проникал во все щели и укрытия. Газовая атака привела к гибели 5000 английских солдат, более 15 000 стали калеками.
История этого газа, враждебного всему живому, начинается с середины XVII в., когда голландский химик Ян Баптист ван Гельмонт едва не погиб, нагревая смесь некой соли с азотной кислотой. А шведский химик и аптекарь Карл Вильгельм Шееле надышался этого вредного газа, изучая реакцию минерала пиролюзита с соляной кислотой. О каком неметалле идет речь?
Ответ. Этот опасный газ - хлор.
Гельмонт для его получения использовал реакцию хлорида аммония с азотной кислотой.
А Шееле проводил реакцию соляной кислоты с диоксидом марганца:
MnO2 + 4HC1 = МпС12 + С12↑ +2Н2О.
4. Получение неметалла X первым осуществил в 1745 г. М.В.Ломоносов. Он действовал на железные опилки жидкостью состава X2SO4, разбавленной водой. Образовавшийся неметалл Ломоносов называл «флогистоном», что в переводе с греческого означает «горючий». Этот же способ выделения X применил в 1766 г. Генри Кавендиш. В 1787 г. Антуан Лавуазье получил X, продувая струю газообразного оксида этого неметалла через нагретый до красного каления ружейный ствол.
Позднее химики разных стран стали использовать для получения этого неметалла реакции алюминия или кремния со щелочами в водной среде или взаимодействие бинарных соединений этого неметалла и кальция с водой. Какой это неметалл?
Ответ. Этот неметалл - водород. В задании речь идет о следующих реакциях:
Fe + Н2О = FeO + Н2,
2А1 + 2NaOH + 6Н2О = 2Na[Al(OH)4] + 3Н2,
Si + 2NaOH + Н2О = Na2SiO3 + 2Н2,
СаН2 + 2Н2О = Са(ОН)2 + 2Н2
5. Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных названий. В 1772 г. шотландский химик, ботаник и врач Даниел Резерфорд назвал его «ядовитым воздухом». Английский химик Джозеф Пристли в том же году назвал его «дефлогистированным воздухом». В 1773 г. шведский химик-аптекарь Карл Вильгельм Шееле дал этому газу название «испорченный воздух». А английский химик Генри Кавендиш в 1774 г. назвал его «удушливый воздух». Наконец, в 1776 г. французский химик Антуан Лавуазье установил, что все названные выше газы - одно и то же вещество, и предложил свое название, в переводе с греческого означавшее «безжизненный воздух». Каково сейчас название этого неметалла?
Ответ. Это — неметалл азот. Название газообразному азоту дал Лавуазье (от греч. а -частица «не» и zoe - «жизнь» (т.е. «азот», значит «безжизненный»)).
6. Первые исследователи, пытавшиеся получить неметалл Х2 в результате электролиза, жестоко поплатились своим здоровьем. Как только этот неметалл вступал в контакт с водородом, происходили сильные взрывы, в нем «горела» даже вода. А любые органические вещества (например, ткань, из которой были сделаны защитные перчатки экспериментаторов, или вазелиновая смазка пришлифованной аппаратуры) в атмосфере «опасного» неметалла вспыхивали и загорались. Какой это неметалл?
Ответ. Это чрезвычайно агрессивный неметалл - фтор.
IV. Конкурс «Лаборатория».
Недаром говорят, что теория проверяется практикой. Для проведения этого конкурса приглашаются по одному человеку от каждой команды к доске для выполнения практического задания.
1. Соберите прибор для получения кислорода. Получите кислород и докажите его наличие. Какими методами собирают кислород?
Ответ. Проводят реакцию разложения перманганата калия:
2КМпО4 = К2Мп04 + МпО2 + О2
и проверяют тлеющей лучинкой: в кислороде она ярко вспыхивает.
2. Соберите прибор для получения водорода. Получите водород и докажите его наличие. Какими методами собирают водород?
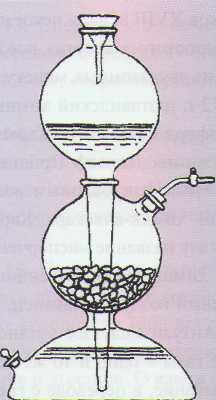
Аппарат Киппа (или аппарат Кирюшкина) – (лабораторный прибор для получения газов действием жидкости на твердое вещество при комнатной температуре)
Ответ. Проводят реакцию взаимодействия цинка с соляной кислотой в аппарате Кипа:
Zn + 2HC1 = ZnC12 + Н2.
Полученный газ проверяют так - к отверстию пробирки подносят горящую спичку,
раздается хлопок.
Ответы учащихся проверяют, используя интерактивную доску.
V. Конкурс «Поэтический».
Учитель загадывает загадки, а команды по очереди отвечают.
• Тяжелый, жидкий и пахучий,
Подвижный, сильно ядовит.
Удушлив и весьма летучий
Сквозь поры пробки он летит.
В солях почти всегда бесцветен,
Есть в Сакском озере в Крыму,
Лечебным действием заметен
И всем известен потому.
(Бром.)
• Из меня состоит все живое,
Графит, антрацит и алмаз.
Я на улице, в школе и в поле,
Я в деревьях и в каждом из вас.
(Углерод)
• Я - газ легчайший и бесцветный,
Неядовитый и безвредный.
Рождаю воду, когда сгораю,
Аэростаты наполняю,
А с кислородом образую
Я смесь горящую, взрывную.
(Водород)
• Гулять в грозу - какой резон?
Подышим воздухом, дружище.
В природе словно стало чище,
Повсюду в воздухе ...
(Озон.)
• Я - коварный поджигатель,
Вы огня хотите - нате!
Я - всесильный окислитель,
Если только дров дадите.
(Кислород)
• Вы со мной уже встречались –
Я - космический скиталец,
Элементов прародитель
И отважный предводитель.
Я - любитель кислорода,
Вместе с ним даю я воду.
(Водород)
• Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня, и под водой
Оксид мой станет кислотой.
(Фосфор)
• Предупреждаю вас заранее:
Я не пригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат.
(Азот)
• У меня дурная слава:
Я - известная отрава.
Даже имя говорит,
Что я страшно ядовит.
(Мышьяк.)
• Рассеян по земле повсюду,
Немного есть в морской воде,
Рассказывать того не буду,
Как обнаружен он везде.
Летучий, темный, кристалличен,
Он мало растворим в воде.
Раствор спиртовый столь обычен,
В аптеках встретится везде.
(Йод.)
VI. Конкурс «Расчетный».
Задача 1. Послушайте отрывок из романа «Затерянный мир» Артура Конан Дойла.
«Сейчас посмотрите, - сказал Челленджер. - Последние дни я напрягал все силы своего ума, чтобы разрешить задачу, как нам выбраться отсюда. Мы же убедились, что спуск по отвесным скалам невозможен, а туннеля больше не существует. Перебросить мост на утес нам, безусловно, не удастся. Что же тогда делать? Я как-то говорил нашему юному другу, что эти гейзеры выделяют водород в свободном состоянии. Отсюда логически вытекла мысль о воздушном шаре».
Рассчитайте, какая масса цинка потребовалась бы, чтобы наполнить шар объемом 1 кубический метр, которым воспользовались бы участники неудавшейся экспедиции.
Ответ.
Zn + 2HC1 = ZnCl2 + Н2↑,
v(H2) = 1000 (л) / 22,4 (л/моль) = 44,64 моль,
v(Zn) = v(H2) = 44,64 моль,
w(Zn) = 44,64 (моль) • 65 (г/моль) = 2901,6 г, или 2 кг 902 г.
Задача 2. Послушайте отрывок из фантастического произведения А.Р.Беляева «Голова профессора Доуэля».
«Первый раз в жизни Артур Доуэль почувствовал, что не в состоянии овладеть чужой волей. Связанный, беспомощный, лежащий на полу человек издевался над ним. За дверью раздалось какое-то шипение. Доуэль продолжал петь все громче, но вдруг поперхнулся. Что-то раздражало его горло. Доуэль потянул носом и почувствовал запах. В горле и носоглотке неприятно щекотало, вскоре к этому присоединилась режущая боль в глазах. Запах усиливался. Доуэль похолодел. Он понял, что Равино отравил его хлором. Настал его смертный час. Затем свет погас, и Доуэль словно провалился... Очнулся он от свежего ветра, который трепал его волосы».
Рассчитайте, какой объем хлора потребуется для получения 1 кг поваренной соли.
Ответ.
2Na + С12 = 2NaCl,
v(NaCl) = 1000 (г) / 58,5 (г/моль) = 17,1 моль,
v(Cl2) = 1/2 • v(NaCl) = 8,55 моль,
V (C12) = 8,55 (моль) • 22,4 (л/моль) = 191,52 л.
Ответы и решение задач осуществляются с помощью интерактивной доски.
VII. Конкурс «Творческий».
Учитель читает стихотворение, которое отражает генетический ряд неметаллов. Вам необходимо это стихотворение перевести на язык химии и записать уравнения соответствующих реакций (для реакций ионного обмена следует составить полные и сокращенные ионные уравнения).
Задание 1.
Пусть эти превращения
Дадут вам уравнения.
Красный фосфор я сжигаю,
К дымку воду приливаю.
Проверяю лакмусом,
Станет сразу красным он!
Добавим натрия гидроксид —
Цвет фиолетовый в колбе возник.
Потом получаю фосфат серебра,
Цветом - лимонная кожура.
Растворяю осадок желтый
Добавлением кислоты азотной.
И на доске превращения эти
Вы запишите, умные дети!
Ответ. Генетический ряд фосфора выглядит следующим образом:
Р → Р2О5 → Н3РО4 → Na3PO4 → Ag3PO4 → Н3РО4.
1) 4Р+5О2 = 2Р2О5
2) Р2О5 + 3Н2О = 2Н3РО4
3) 3NaOH + Н3РО4 = Na3PO4+ 3H2O
3Na+ + 3ОН- + 3Н+ + РО43- = 3Na+ + РО43- + 3H2O
ОН- +Н+=Н2О
4) Na3PO4 + 3 AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + РО43- +3 Ag+ + 3NO3- = Ag3PO4↓ + 3Na+ + 3NO3-
3 Ag+ + РО43- = Ag3PO4↓
5) Ag3PO4+ 3HNO3 = H3PO4+ 3AgNO3.
Задание 2.
Бросим мы в костер бревно
И получим вещество.
В кислороде он горит —
Получается оксид.
А затем оксид другой,
Догадайтесь вот, какой?
Есть он в воздухе и в нас.
В лимонаде тот же газ.
Ну, а если мы прибавим
Гидроксида натрия,
То получим очень скоро
Соль такую знатную.
Станет пышным с ней пирог,
И подумать кто бы мог!
Разлагаем эту соль
Мы при нагревании.
В результате получаем
Соль с другим названием.
Сыпем кальция хлорид,
Видим изменения,
Белый порошок возник –
Признак без сомнения.
Растворяем в кислоте,
Видим пузырьки на дне,
Газ какой-то или что же,
Кто ответит верно мне?
Смело пишем на доске
Чудо превращения.
Классы нам веществ нужны –
Все без исключения.
Ответ. Генетический ряд углерода выглядит следующим образом:
С → СО → СО2 → NaHCO3 → Na2CO3
1)2С+О2=2СО
2) 2СО + О2 = 2СО2
3) СО2 + NaOH = NaHCO3
4) 2NaHCO3 = Na2CO3 + CO2 + H2O
5) Na2CO3 + CaCl2 = CaCО3 + 2NaCl
2Na+ + CO32- + Ca2+ + 2C1- = CaCO3 + 2Na+ + 2C1-
CO32- +Са2+ = СаСО3
6) CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
Маршрутный лист «Неметаллы»
-
Положение неметаллов в ПС.
B
 неМе
неМе
At
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат.
-
Строение атомов неметаллов.
| III A | IV A | V A | VI A | VII A | VIII A | ||||||||||||||||||
| B 1s22s22p1
2p1 | C 1s22s22p2
2p2 | N 1s22s22p3
2p3 | O 1s22s22p4
2p4 | F 1s22s22p5
2p5
| Ne 1s22s22p6
2p6 | ||||||||||||||||||
| 2s2 | ↑ |
|
| 2s2 | ↑ | ↑ |
| 2s2 | ↑ | ↑ | ↑ | 2s2 | ↑↓ | ↑ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ||||||||||||
Для атомов неметаллов, по сравнению с атомами металлов характерны:
* меньший атомный радиус;
* четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов оттягивать к себе общие электронные пары.
3. Кристаллическое строение неметаллов - простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
* газы – H2, O2, O3, N2, F2, Cl2;
* жидкость – Br2;
* твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
 Причины аллотропии:
Причины аллотропии:

Образование молекул с разным Образование различных
числом атомов (кислород, озон) кристаллических форм (алмаз, графит)
4. Физические свойства неметаллов.

 Неметаллы
Неметаллы

5. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями.
Выводы:
1) Элементы-неметаллы расположены в главных подгруппах ….. ….. ПС
Д.И. Менделеева, занимая её верхний правый угол.
2) На внешнем электронном слое атомов элементов-неметаллов находятся от … до… электронов.
3) Неметаллические свойства элементов ………….. в периодах и ………….. в подгруппах с увеличением порядкового номера элемента.
4) Высшие кислородные соединения неметаллов имеют ………….. характер.
5) Атомы элементов-неметаллов способны как ………… электроны, проявляя окислительные функции, так и ………….. их, проявляя восстановительные функции.
Тест по теме «Неметаллы»
1) Вставьте слова, пропущенные в тексте:
Атомы ………………. в отличие от атомов………………….. легко принимают наружные электроны, являются ……………………
2) Вставьте слова, пропущенные в тексте:
Неметаллические свойства элементов с увеличением порядкового номера в периодах ………………………
В группах неметаллические свойства элементов …………………….
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?

4) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Соотнесите, какую высшую степень окисления имеют следующие элементы?
Азот +6
Хлор +5
Сера +4
Кремний +7
7) Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S —
2SO2 + O2 → 2SO3
S—
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно…..
а) 4 б) 5 в) 6 г) 7
9) Наиболее электроотрицательными являются атомы
а) серы
б) фосфора
в) кремния
г) хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
а) 2, 1
б) 2, 8, 2
в) 2, 8, 7
Характеристика азота:
| Показатель | Значение |
| 2 – радиус атома – |
|
| 2 – радиус иона – |
|
| 6 – содержание в земной коре |
|
| 9 – температура плавления – |
|
| 9 – температура кипения - |
|
| 13 – количество изотопов - |
|
Характеристика углерода:
| Показатель | Значение |
| 2 – радиус атома – |
|
| 2 – радиус иона – |
|
| 6 – содержание в земной коре |
|
| 9 – температура плавления – |
|
| 9 – температура кипения - |
|
| 13 – количество изотопов - |
|
Характеристика серы:
| Показатель | Значение |
| 2 – радиус атома – |
|
| 2 – радиус иона – |
|
| 6 – содержание в земной коре |
|
| 9 – температура плавления – |
|
| 9 – температура кипения - |
|
| 13 – количество изотопов - |
|
Маршрутный лист «Неметаллы»
-
Положение неметаллов в ПС.
- Где в ПС расположены неметаллы?
B
 неМе
неМе
At
- Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат.
-
Строение атомов неметаллов.
| III A | IV A | V A | VI A | VII A | VIII A | ||||||||||||||||||
| B 1s22s22p1
2p1 | C 1s22s22p2
2p2 | N 1s22s22p3
2p3 | O 1s22s22p4
2p4 | F 1s22s22p5
2p5
| Ne 1s22s22p6
2p6 | ||||||||||||||||||
| 2s2 | ↑ |
|
| 2s2 | ↑ | ↑ |
| 2s2 | ↑ | ↑ | ↑ | 2s2 | ↑↓ | ↑ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑ | 2s2 | ↑↓ | ↑↓ | ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ↑↓ |
| ||||||||||||
Для атомов неметаллов, по сравнению с атомами металлов характерны:
* меньший атомный радиус;
* четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов оттягивать к себе общие электронные пары.
3. Кристаллическое строение неметаллов - простых веществ. Аллотропия.
Неметаллы имеют 2 типа кристаллических решёток:
- молекулярные (H2, O2, O3, N2, Cl2),
- атомные (алмаз, графит, кремний).
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь.
Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии - способность атомов одного химического элемента образовывать несколько простых веществ, а эти простые вещества называются аллотропными видоизменениями или модификациями.
 Причины аллотропии:
Причины аллотропии:

Образование молекул с разным Образование различных
числом атомов (кислород O2, озон O3) кристаллических форм (алмаз, графит),
разное строение кристаллических решёток
Р4 – белый фосфор – молекулярная К.Р.,
Р – красный фосфор – атомная К.Р.
4. Физические свойства неметаллов.

 Неметаллы
Неметаллы

В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
* газы – H2, O2, O3, N2, F2, Cl2;
* жидкость – Br2;
* твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода.
Температуры плавления у графита – 3800, у азота - -210 градусов.
5. Химические свойства неметаллов.
- Кем являются неметаллы в химических реакциях?
- Неметаллы в химических реакциях могут быть и восстановителями, и окислителями.
Выводы:
1) Элементы-неметаллы расположены в главных подгруппах IV-VII групп ПС
Д.И. Менделеева, занимая её верхний правый угол.
2) На внешнем электронном слое атомов элементов-неметаллов находятся от 4 до 8 электронов.
3) Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
4) Высшие кислородные соединения неметаллов имеют кислотный характер.
5) Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
1 уровень (красные карточки) - творческое задание:
Перевести стихотворение на язык химии и записать уравнения соответствующих реакций (для реакций ионного обмена составить полные и сокращенные ионные уравнения).
Бросим мы в костер бревно
И получим вещество.
В кислороде он горит —
Получается оксид.
А затем оксид другой,
Догадайтесь вот, какой?
Есть он в воздухе и в нас.
В лимонаде тот же газ.
Ну, а если мы прибавим
Гидроксида натрия,
То получим очень скоро
Соль такую знатную.
Станет пышным с ней пирог,
И подумать кто бы мог!
Разлагаем эту соль
Мы при нагревании.
В результате получаем
Соль с другим названием.
Сыпем кальция хлорид,
Видим изменения,
Белый порошок возник –
Признак без сомнения.
Растворяем в кислоте,
Видим пузырьки на дне,
Газ какой-то или что же,
Кто ответит верно мне?
Смело пишем на доске
Чудо превращения.
Классы нам веществ нужны –
Все без исключения.
Ответ. Генетический ряд углерода выглядит следующим образом:
С → СО → СО2 → NaHCO3 → Na2CO3
1)2С+О2=2СО
2) 2СО + О2 = 2СО2
3) СО2 + NaOH = NaHCO3
4) 2NaHCO3 = Na2CO3 + CO2 + H2O
5) Na2CO3 + CaCl2 = CaCО3 + 2NaCl
2Na+ + CO32- + Ca2+ + 2C1- = CaCO3 + 2Na+ + 2C1-
CO32- +Са2+ = СаСО3
6) CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0
|
| 2 уровень (зелёные карточки): осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С» С0 ← С2+ → С4+ «S» S2- ← S6+ → S4+ «N» N2+ ← N3- → N0 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
| 3 уровень (жёлтые карточки): докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C → CH4 → CO2 → CaCO3 → Ca(HCO3)2 «S» S → H2S → SO2 → SO3 → H2SO4 «N» NH4Cl → NH3 → NO → NO2 → НNO3
|
Выпишите общие и специфические химические свойства веществ:
| Вещества | Общие свойства | Отличительные свойства |
| Простые вещества – неметаллы
|
|
|
| Оксиды – 1 группа
|
|
|
| Кислоты – 2 группа
|
|
|
| Соли – 3 группа
|
|
|
© 2021, Вечёрко Татьяна Анатольевна 5110 245
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Полезное для учителя























