Презентация по теме "Обратимость химических реакций. Химическое равновесие" для 11 класса, базового уровня, по одночасовой программе О.С.Габриеляна. Подойдет и для 9 класса, изучающих химию по ФГОС
Просмотр содержимого документа
«"Обратимость химических процессов"»

Обратимость химических реакций
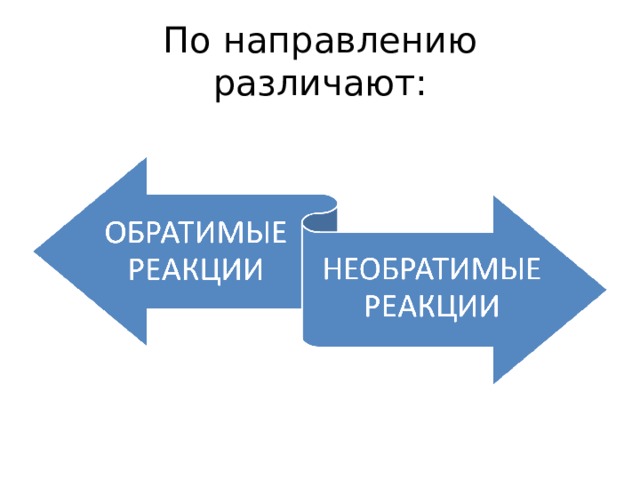
По направлению различают:
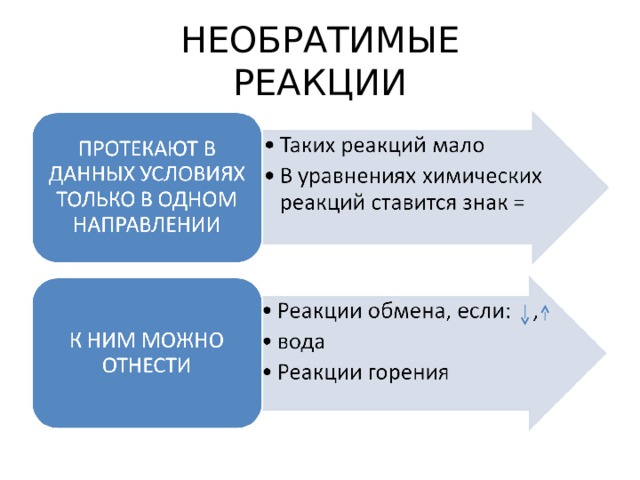
НЕОБРАТИМЫЕ РЕАКЦИИ
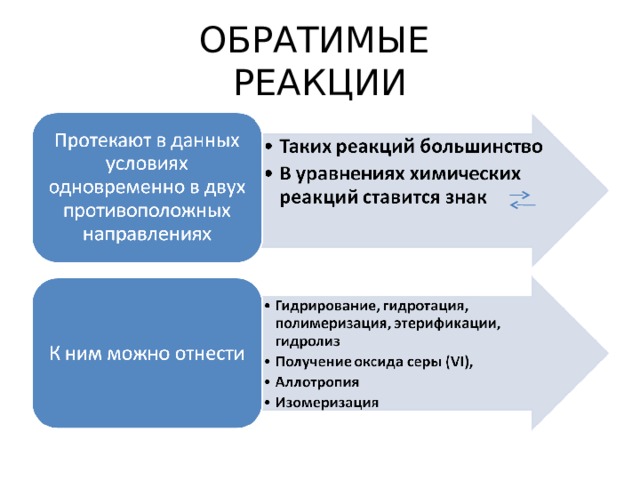
ОБРАТИМЫЕ РЕАКЦИИ
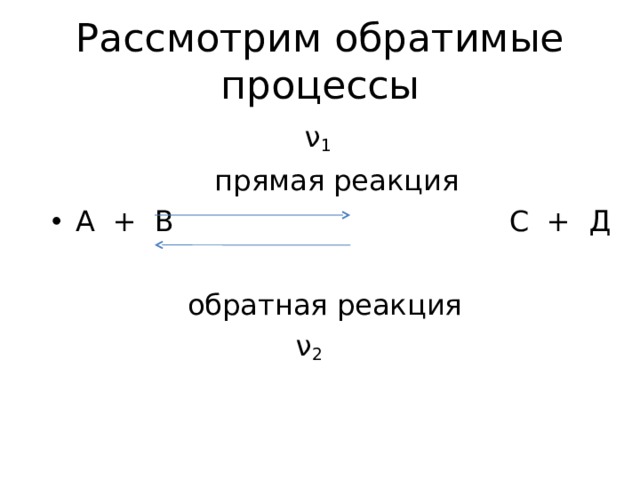
Рассмотрим обратимые процессы
ν 1
прямая реакция
обратная реакция
ν 2
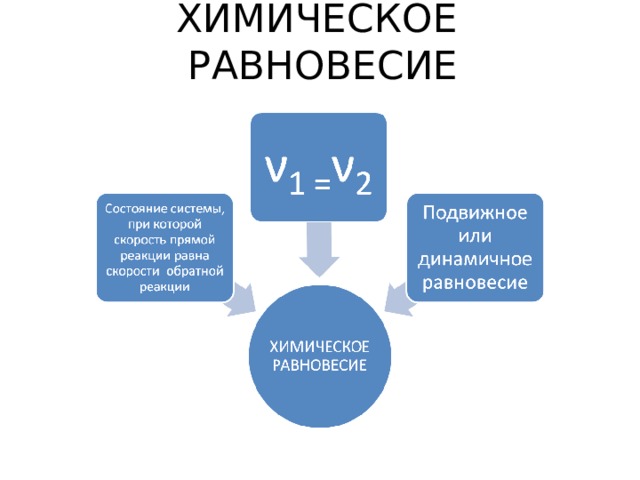
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
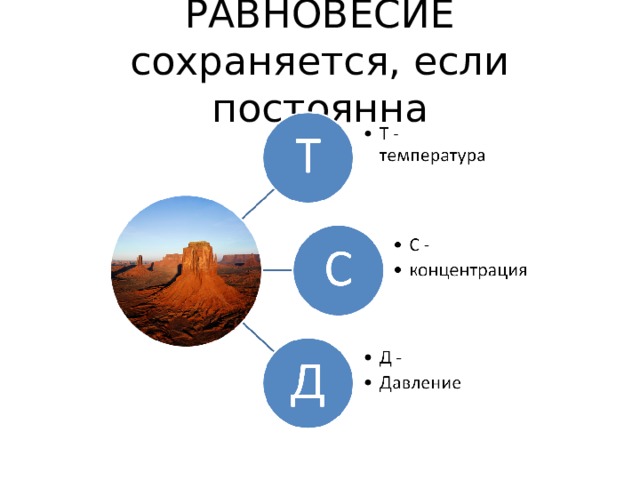
РАВНОВЕСИЕ сохраняется, если постоянна
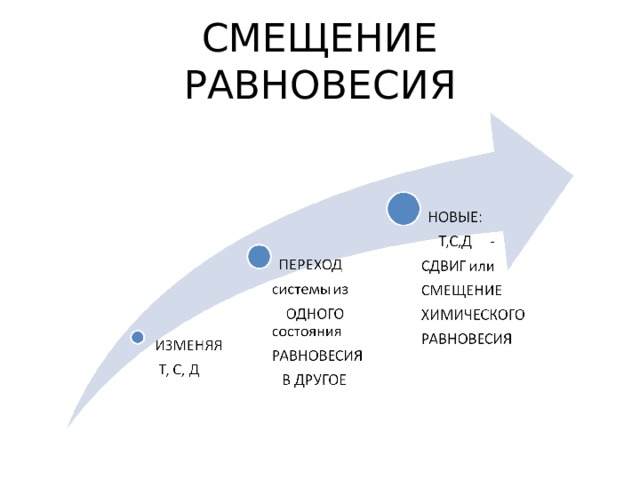
СМЕЩЕНИЕ РАВНОВЕСИЯ
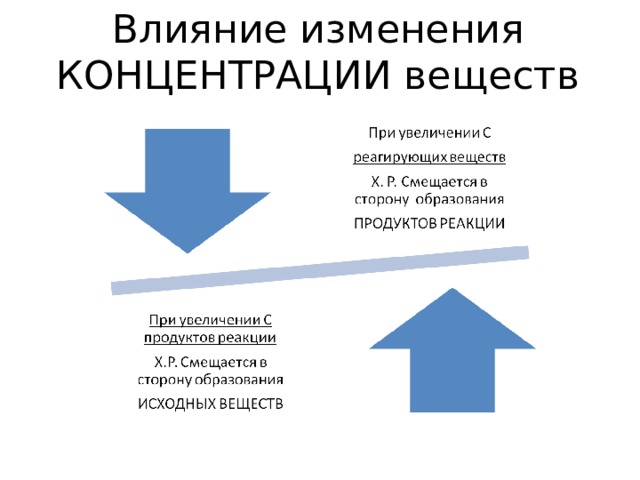
Влияние изменения КОНЦЕНТРАЦИИ веществ
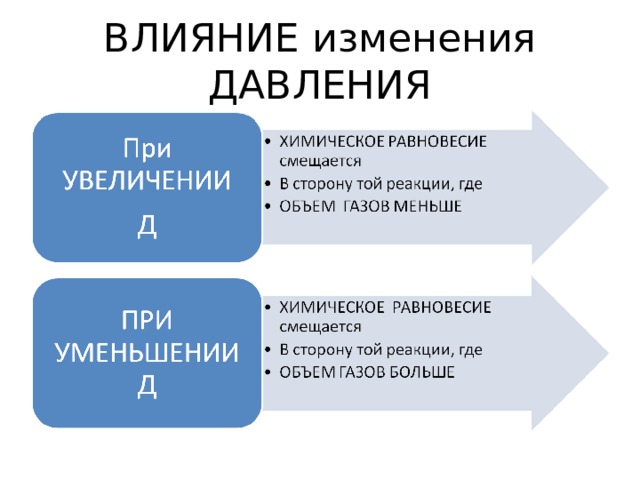
ВЛИЯНИЕ изменения ДАВЛЕНИЯ
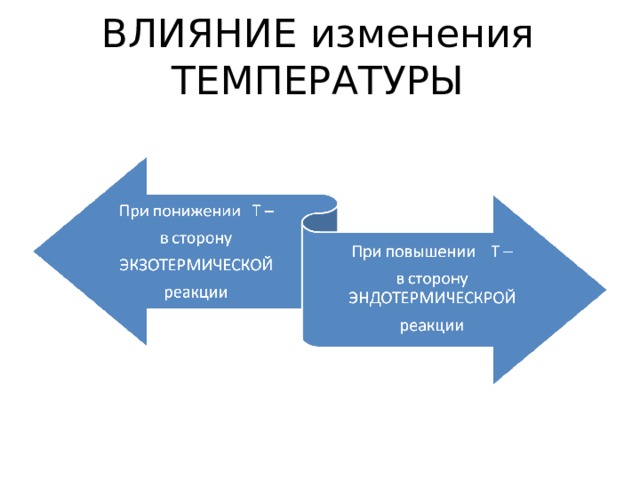
ВЛИЯНИЕ изменения ТЕМПЕРАТУРЫ
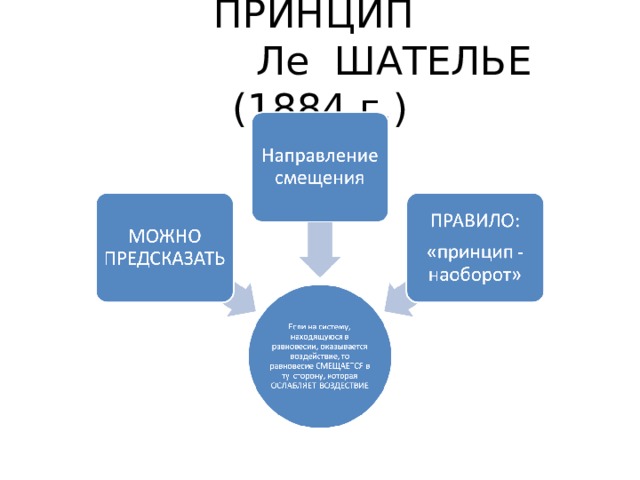
ПРИНЦИП Ле ШАТЕЛЬЕ (1884 г.)

ПРИМЕР
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака :
N 2 + 3 H 2 2 NH 3 + Q

Изменение концентрации ( С ) веществ:
- При увеличении С: азота N 2 и водорода Н 2 увеличивается ( ) скорость прямой реакции ( ν 1 ), равновесие смещается ( )
вправо, в сторону продукта реакции , то есть в сторону образования аммиака NH 3
2) При увеличении С продукта реакции аммиака увеличивается скорость обратной реакции ( ν 2 ), равновесие смещается влево( ), в сторону образования исходных веществ – азота и водорода
 Д: в сторону 2) При Д, ? ( 2 – 2 ) 3) Так как равные объемы, то не сказывается на смещение равновесия " width="640"
Д: в сторону 2) При Д, ? ( 2 – 2 ) 3) Так как равные объемы, то не сказывается на смещение равновесия " width="640"
Влияние изменения давления
N 2 + 3 H 2 2 NH 3 + Q
газ газ газ
1 v + 1 v = 2 v
2 v = 2 v
2) При Д, ? ( 2 – 2 )
3) Так как равные объемы, то не сказывается на смещение равновесия
 T : в сторону эндотермической реакции, то есть влево , в сторону обратной реакции ( ) 2) При : в сторону экзотермической реакции, то есть вправо , в сторону прямой реакции( ) " width="640"
T : в сторону эндотермической реакции, то есть влево , в сторону обратной реакции ( ) 2) При : в сторону экзотермической реакции, то есть вправо , в сторону прямой реакции( ) " width="640"
Влияние изменения температуры ( T)
N 2 + H 2 2 NH 3 + Q
1 ) При T : в сторону эндотермической реакции, то есть влево , в сторону обратной реакции ( )
2) При : в сторону экзотермической реакции, то есть вправо , в сторону прямой реакции( )
ДОМАШНЕЕ ЗАДАНИЕ





















 Д: в сторону 2) При Д, ? ( 2 – 2 ) 3) Так как равные объемы, то не сказывается на смещение равновесия " width="640"
Д: в сторону 2) При Д, ? ( 2 – 2 ) 3) Так как равные объемы, то не сказывается на смещение равновесия " width="640"
 T : в сторону эндотермической реакции, то есть влево , в сторону обратной реакции ( ) 2) При : в сторону экзотермической реакции, то есть вправо , в сторону прямой реакции( ) " width="640"
T : в сторону эндотермической реакции, то есть влево , в сторону обратной реакции ( ) 2) При : в сторону экзотермической реакции, то есть вправо , в сторону прямой реакции( ) " width="640"











