
Металлы: общая характеристика.

Химические элементы – металлы .
Из 114 известных элементов – 92 относятся к металлам.
Металлы – это химические элементы, атомы которых отдают электроны внешнего
( предвнешнего) электронного слоя, превращаясь в положительные ионы (катионы).
![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности ( от 0,7 до 1,9 ). Исключительно восстановительные свойства ( - свои электроны ). Некоторые химические элементы металлы обладают двойственными свойствами ( амфотерность ).](https://fsd.multiurok.ru/html/2018/02/21/s_5a8dbe02c3d0b/img2.jpg)
Главные особенности элементов металлов.
Малое число валентных электронов ( [1-3] ).
Сравнительно большие радиусы атомов.
Небольшие значения электроотрицательности ( от 0,7 до 1,9 ).
Исключительно восстановительные свойства ( - свои электроны ).
Некоторые химические элементы металлы обладают двойственными свойствами ( амфотерность ).

Нахождение в ПСХЭ Д.И. Менделеева
Группа I II III IV V VI VII VIII
Элементы побочных подгрупп – металлы (переходные или d – элементы.
Период
1
2 Li B
3
4
5
6 At
7 Fr
Все элементы-
металлы:
s –; p –; d –; f -.

Изменение свойств в ПСХЭ Д.И. Менделеева
В главной подгруппе
Число электронов на внешнем слое не изменяется
Радиус атома увеличивается
Электроотрицательность уменьшается
Восстановительные свойства усиливаются
Металлические свойства усиливаются

Изменение свойств в ПСХЭ Д.И. Менделеева
В периоде:
Заряды ядер увеличиваются
Радиусы атомов уменьшаются
Число электронов на внешнем слое увеличивается
Электроотрицательность увеличивается
Восстановительные свойства уменьшаются
Металлические свойства ослабевают
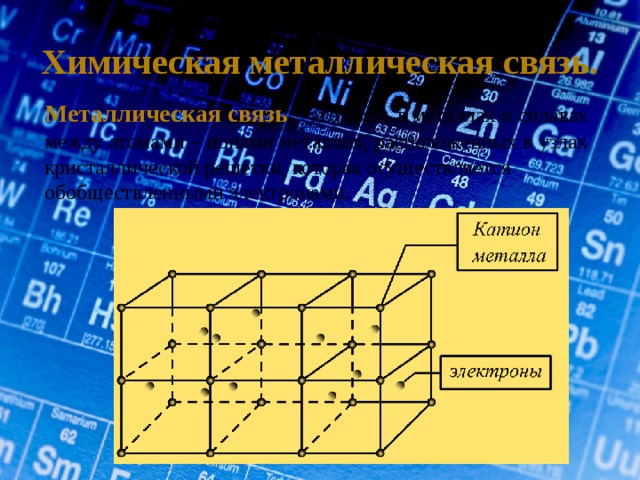
Химическая металлическая связь.
Металлическая связь – это связь в металлах и сплавах между атомами – ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществленными электронами.
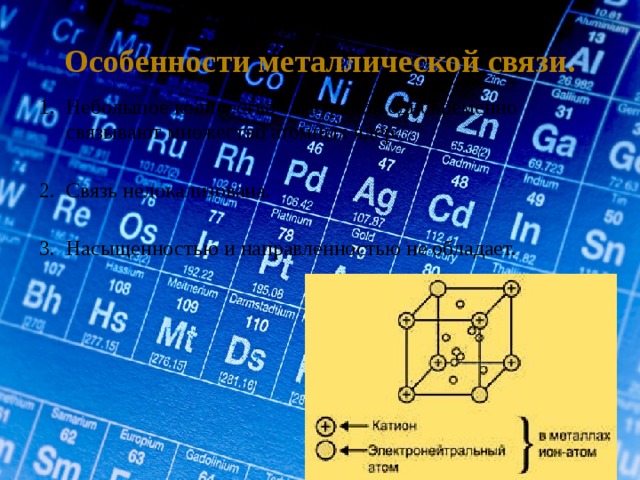
Особенности металлической связи.
1. Небольшое количество электронов одновременно
связывают множество атомных ядер.
2. Связь нелокализована.
3. Насыщенностью и направленностью не обладает.

Металлы – простые вещества.
Все металлы обладают общими физическими свойствами:
Пластичность – смещение слоев ионов под внешним воздействием на кристалл относительно друг друга.
Металлический блеск – наличие свободных электронов.
Электро- и теплопроводность – обусловлена нахождением в кристалле хаотически движущихся электронов.

Металлы – простые вещества.
В атомах металлов на внешнем энергетическом уровне:
- Малое количество электронов.
- Очень большой атомный радиус.
Способствует быстрой отдаче электронов атомом металла в результате их взаимодействия с другими атомами
окисление

Электрохимический ряд напряжения металлов.
Ме расположены в порядке убывания восстановительных свойств при реакциях в растворах;
Ме, стоящий в ряду до водорода, вытесняет его из растворов кислот;
Ме, стоящий в ряду левее, вытесняет правее стоящий Ме из растворов его солей;

Электрохимический ряд напряжения металлов.
Ме, стоящие в ряду до Al, взаимодействуют с водой с образованием щелочей и выделением водорода;
остальные Ме – в жестких условиях с образованием оксида Ме и водорода;
Ме, стоящие в ряду за водородом, не взаимодействуют с водой;

Электрохимический ряд напряжения металлов.
На основании восстановительной способности Ме в ряду напряжений УСЛОВНО можно разделить на три группы:
от Li до Al
от Al до H 2
очень активные металлы.
металлы средней активности
Me
от Н 2 до Au
малоактивные металлы
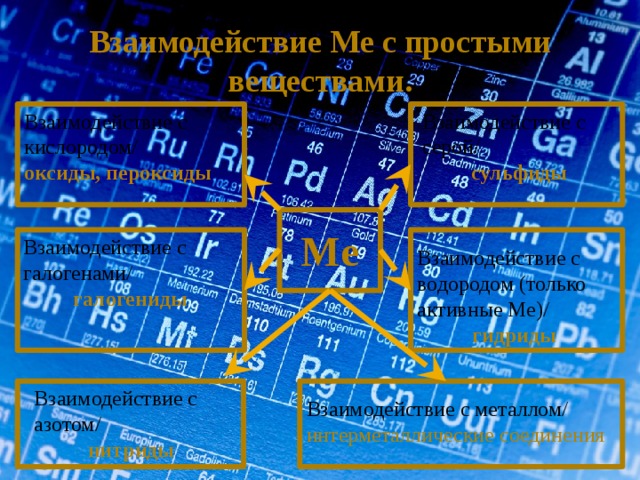
Взаимодействие Ме с простыми веществами.
Взаимодействие с кислородом/
Взаимодействие с серой/
оксиды, пероксиды
сульфиды
Ме
Взаимодействие с галогенами/
галогениды
Взаимодействие с водородом (только активные Ме)/
гидриды
Взаимодействие с металлом/
интерметаллические соединения
Взаимодействие с азотом/
нитриды
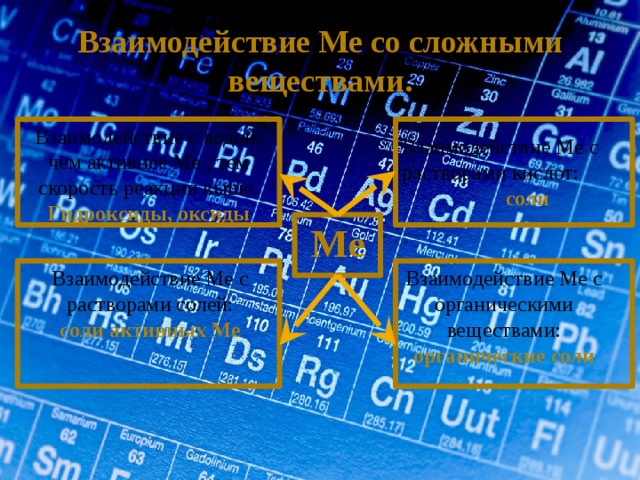
Взаимодействие Ме со сложными веществами.
Взаимодействие с водой:
чем активнее Ме , тем скорость реакции выше.
Гидроксиды, оксиды
Взаимодействие Ме с растворами кислот:
соли
Ме
Взаимодействие Ме с органическими веществами:
Взаимодействие Ме с растворами солей:
органические соли
соли активных Ме









![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности ( от 0,7 до 1,9 ). Исключительно восстановительные свойства ( - свои электроны ). Некоторые химические элементы металлы обладают двойственными свойствами ( амфотерность ).](https://fsd.multiurok.ru/html/2018/02/21/s_5a8dbe02c3d0b/img2.jpg)































