8 класс
8-1
Число атомов водорода в молекуле хлорной кислоты - 1
Число атомов в молекуле серы – 8
Число молекул воды в кристаллогидрате медного купороса – 5
Число элементов в молекуле аммиака - 2
Система оценивания:
За каждый верный ответ по 2 балла
Итого: 8 баллов
8 -2
Переведем данные концентрации хлоридов в удобные единицы:
27 200 000 т/км3 – 27,2 г/л NaCl
3 800 000 т/км3 – 3,8 г/л MgCl2
750 000 т/км3 - 0,75 г/л KCl.
Количество вещества солей: n(NaCl) = 27,2 : 58,5 = 0,465 моль
n(MgCl2 ) = 3,8 : 95 = 0,04 моль, n(KCl) = 0,75 : 74,5 = 0,01моль.
Суммарное количество вещества хлорид-ионов :
n(Cl-) = 0,465 +0,08 + 0,01 = 0,555 моль.
m(Cl-) = 0,555 моль⋅35,5 г/моль= 19,7 г
Это во много раз превышает благоприятное для растений содержание хлорид-ионов. Вода для полива не пригодна.
Система оценивания:
Пересчет содержания солей - 3 балла
Расчет количества вещества солей – 3 балла
Расчет количества вещества хлорид-ионов - 3 балла
Расчет массы хлорид-ионов в литре воды - 1 балл
Итого: 10 баллов
8 -3
Химический процесс – горение;
Физические процессы – экстракция солей из золы, фильтрация
Формулы солей - NaCl, Na2CO3, K2CO3,
Система оценивания:
За химический и физические процессы по 1 баллу - 3 балла
За формулы солей по 2 балла - 6 баллов
Итого: 9 баллов
8- 4
1) С + 2Н2О = СО2+ 2Н2 2Н2 + О2 = 2Н2О
2) Известно, что присутствие воды в процессе горения не обязательно, но вода выступает в роли катализатора окисления, как для углерода, так и для водорода.
Система оценивания:
За уравнения реакций по 3 балла – 6 баллов
За установление роли воды - 4 балла
Итого: 10 баллов
8 -5
Схема реакции: Ме + НAn = MeAn + ½ H2
Масса прореагировавшего металла:
m(Me) = 0,182⋅50 = 0,913 г
n(H2) = 0,365 л : 22,4 л/моль = 0,0163 моль.
Если степень окисления металла +1, то М(Ме) = m/n = 0,193 : 2⋅0,0163 =28 г/моль.
Такого металла нет.
Если степень окисления металла +2, то М(Ме) = 0,193 : 0,0163 = 56 г/моль.
Искомый металл - железо.
Система оценивания:
За схему реакции – 3 балла
За расчет массы металла – 2 балла
За расчет объема водорода – 2 балла
За определение металла - 6 баллов
Итого: 13 баллов
9 класс
9 – 1
Уравнение реакции: 2Mg + CO2 = 2MgO + C.
По уравнению реакции: n(MgO) = n(Mg); n(C) = 0,5n(Mg).
По условию задачи:
n(MgO) = m(Mg) : M(Mg) = 18 г : 24 г/моль = 0,75 моль
n(MgО) = 0,75 моль, m(MgО) = 0,75 моль ⋅40 г/моль = 30 г
n(C) = 0,375 моль; m( C) = 0,375 моль ⋅12 г/моль = 4,5 г.
ω(MgO) = m(MgO)/ mтв. остатка = 30: 34,5⋅ 100% = 87%
ω(С) = 0,13.
По уравнению: n(CО2) = 0,5n(Mg),
По условию задачи: n(CО2) = 0,375 моль;
Vпрореагировавшего(CО2) = 0,375 моль⋅22.4 л/моль = 8,4 л.
Vоставш(CО2) = 28л – 8,4л = 19,6 л
(CО2) = 19,6 : 28 ⋅ 100% = 70%
Объем добавленного воздуха = 8,4 л
В нем (О2) = 0,21V(О2 ) = 8,4 ⋅0,21 = 1,76 л;
(N2) = 0,78; V(N2) = 8,4 ⋅0,78 = 6,64 л.
В оставшейся газовой смеси:
(О2) = 1,76 : 28 = 6,3%
(N2) = 6,64 : 28 ⋅ 100% = 23,7%
Система оценивания:
За уравнение реакции – 2 балла
За расчет массовых долей компонентов твердого остатка - 3 балла
За расчет объемной доли СО2 - 3 балла
За расчет объемных долей кислорода и азота - 5 баллов.
Итого: 13 баллов
9 -2
Поскольку кислота может проходить через медные трубы лишь в разбавленном состоянии, то это значит, что в концентрированном состоянии она их разрушает, реагируя с медью. В условиях указано, что кислота образована одним из элементов первых трех периодов, то есть это может быть либо H2SO4, либо HNO3. Но так как исходное вещество — твердое, то оно может быть только серой.
Если сера проходит через огонь, она, естественно, сгорает до SO2:
S + O2 = SO2 (1)
Растворение SO2 в воде приводит к образованию сернистой кислоты:
SO2 + H2O = H2SO3 (2)
При хлорировании же сернистой кислоты протекает дующая реакция:
H2SO3 + Н2O + Cl2= H2SO4 + 2HCl (3)
Серной кислоте, которая при этом образуется, в концентрированном состоянии, да еще при повышенной температуре, медные трубы и впрямь не преодолеть, так как будет протекать следующая реакция:
Сu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O (4)
Система оценивания:
За установление исходного вещества - 2 балла
За уравнения 1, 2 по 1 баллу - 2 балла
За уравнения 3, 4 по 2 балла – 4 балла
Итого: 8 баллов
9-3
А – NaCl, Б – NaI, В – HCl, Г – I2, Д – H2S
NaCl + H1SO4 = HCl + NaHSO4 (1)
8NaI + H1SO4 = 4I2 + H2S + 8NaHSO4 + 4H2O (2)
4HCl + 4NaI + O2 = 2 I2 + 4NaCl + 2 H2O (3)
Cистема оценивания:
За каждое вещество по 1 баллу - 5 баллов
За уравнение (1) - 1 балл
За уравнения (2), (3) по 2 балла - 4 балла
Итого: 10 баллов.
9-4
Из описания опыта видно, что летучее масло с запахом хлора - это и есть хлор, только жидкий. Следовательно, Фарадей получил гидрат хлора; при нагревании он разлагается на воду и хлор, который в условиях опыта перешел в жидкое состояние. (Даже если Вы не знали о существовании такого соединения, то из условия задачи следует, что оно все-таки существует.) 21,5 г кристаллогидрата содержат 21,5–14,4 = 7,1 г хлора,
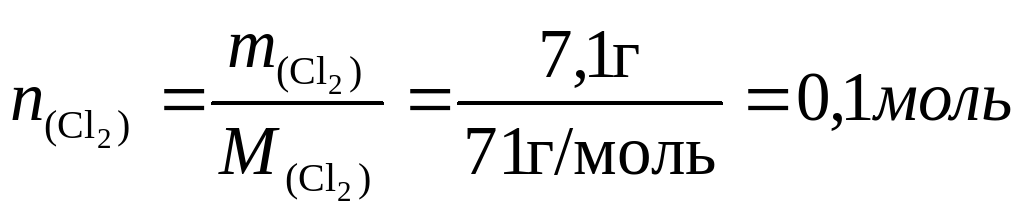
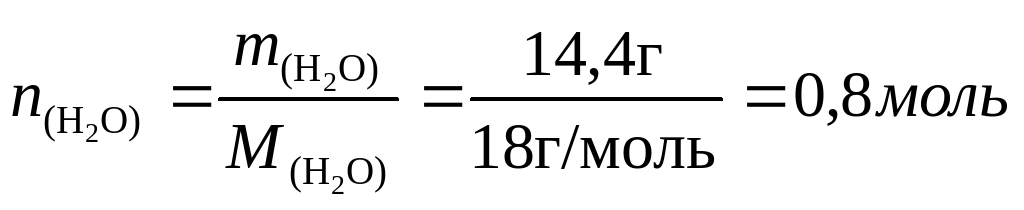
Следовательно, формула кристаллогидрата С12‧8Н2O.
Система оценивания:
За объяснение результатов опыта – 5 баллов
За расчет формулы кристаллогидрата – 3 балла.
Итого: 8 баллов
9-5
Из уравнения реакции
NaHCO3 + HCl = NaCl + H2O + CO2↑
Видно, что n(CO2) = n(NaCl)
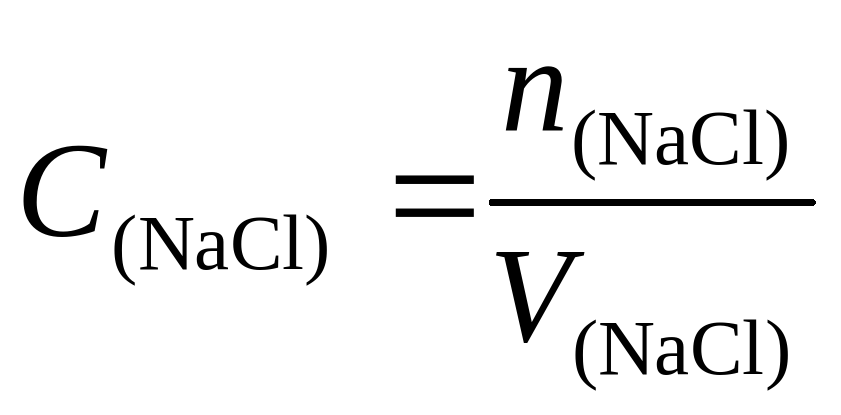 ⇒n(NaCl) = C(NaCl)V(NaCl)
⇒n(NaCl) = C(NaCl)V(NaCl)
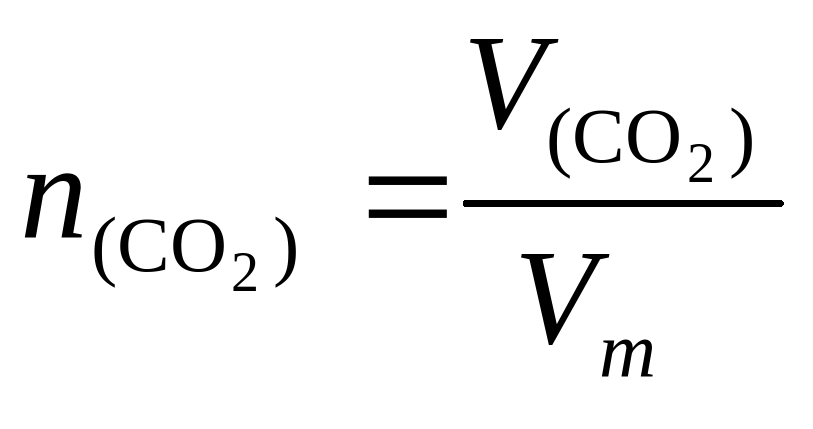
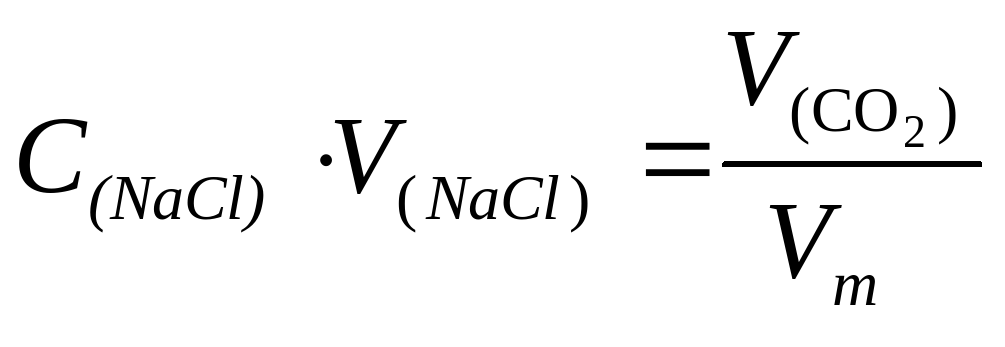
Из условия известно, что объем выделившегося газа в 2 раза больше, чем объем раствора соли.
Обозначим V(NaCl) = х, тогда
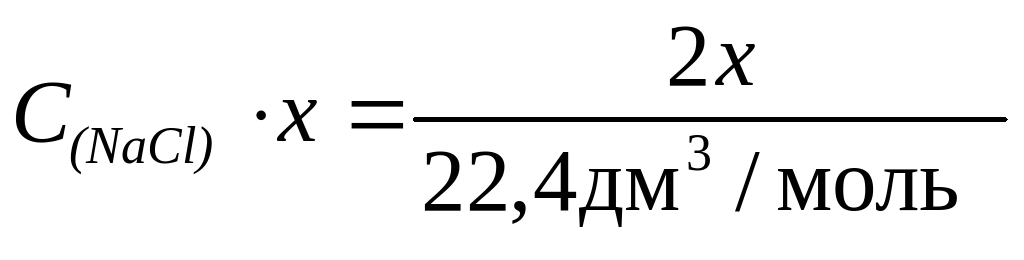
Решая уравнение, получим C(NaCl) = 0,09 моль/дм3
Система оценивания:
За уравнение реакции - 1 балл
За выражение концентрации хлорида натрия - 4 балла
За расчет концентрации - 6 баллов.
Итого: 11 баллов
10 класс
10-1
Для определения металла в составе карбоната Ме2(CO3)n составим уравнение:
Обозначим молярную массу металла через х.
ω(Ме)= 2x/ (2x+60n)= 0,2857, откуда x = 12n
| n | x | Me |
| 1 | 12 | - |
| 2 | 24 | Mg |
| 3 | 36 | - |
| 4 | 48 | Ti |
Поскольку карбонат титана (II) не существует, искомый металл – магний.
n(MgCO3) = 4,2: 84 = 0,05 моль.
Так как в растворе после удаления осадка остались только хлорид- и карбонат-анионы, в состав бишофита входят хлорид-ионы.
Проверим, входит ли в состав минерала натрий.
n(Na2CO3) = ω(Na2CO3) ·mp-pa·ρ / M(Na2CO3) = 0,1· 100 ·1,102 / 106 = 0,104 моль
n(Na+)= 0,208 моль.
mоставшегося раствора = 10,15 + 50 + 110,2 – 4,2 = 166,15 г
m(Na+) = 166,15 · 0,288 = 4,79 г n(Na+)= 4,79 : 23 = 0,208 моль.
То есть весь натрий, содержащийся в растворе, был в составе карбоната натрия.
В бишофите его нет. Следовательно, получена формула MgCl2.
Установим, является ли она истинной.
n(MgCl2) = n(Mg) = 0,05 моль
m(MgCl2) = 0,05 моль ·95г/моль = 4,75 г. Значит бишофит – кристаллогидратMgCl2·хН2О
Найдем количество кристаллизационной воды
(95 + 18х) ·0,05 = 10,15, х = 6
Истинная формула бишофита - MgCl2·6Н2О
Система оценивания:
Определение катиона металла - 3 балла
Установление аниона - 1 балл
Доказательство отсутствия катиона натрия - 3 балла
Расчет кристаллизационной воды - 3 балла
Итого: 10 баллов
10-2
Уравнения реакций нейтрализации:
SO3 + 2NaOH = Na2SO4 + H2O (1)
H2SO4 + 2NaOH = Na2SO4 + 2H2O (2)
Обозначим количества вещества компонентов олеума:
n(SO3) = x; n(H2SO4) = y;
По уравнению (1): n(NaOH) = 2x;
По уравнению (2): n(NaOH) = 2y.
Масса щелочи в растворе:
m(NaOH) = ω(NaOH) ⋅Vp-pa⋅ρ = 0,3⋅105⋅1,33= 41,9 г
Составим систему уравнений:
8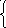 0х + 98y = 50
0х + 98y = 50
80x + 80y = 41,9 , откуда y = 0,45 моль, х= 0,074 моль.
m(SO3) = М(SO3) ⋅ n(SO3) = 80г/моль ⋅0,074 моль = 5,9 г
ω(SO3) = m(SO3)/ mолеума = 5,9 г : 50 г = 0,118 или 11,8%
Система оценивания:
За уравнения реакций по 1 баллу - 2 балла
За расчет массы щелочи -1 балл
За составление системы уравнений – 5 баллов
За расчет массовой доли SO3 - 3 балла
Итого: 10 баллов
10-3
При 300 ºС германий реагирует с йодом, давая дийодид:
Ge + I2 = GeI2,
который, диффундируя в другой конец трубки, при 250 ºС диспропорционирует по схеме:
2GeI2 = Ge + GeI4
В результате на подложке осаждается пленка чистого германия. Но тетрайодид, диффундируя в горячий конец трубки, начинает взаимодействовать с германием, давая дийодид, так как при 250 °С равновесие второй реакции смещено влево: дийодид, диффундируя в холодный конец трубки, вновь диспропорционирует, и слой германия на подложке растет.
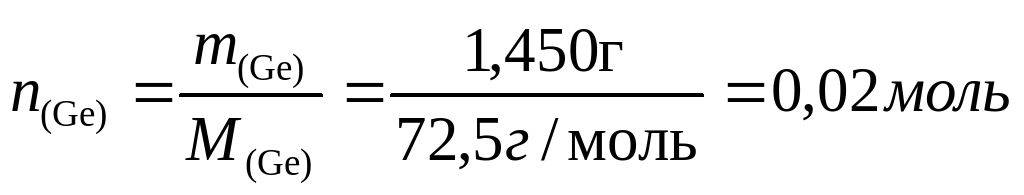
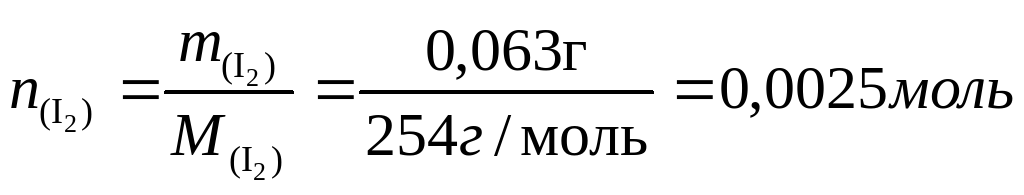
При 600ºС равновесие реакции германия с йодом сильно сдвинуто в сторону исходных веществ и из трубки откачиваются только пары йода. Если откачку производить при 250°, когда в газовой фазе находится тетрайодид, потери составят
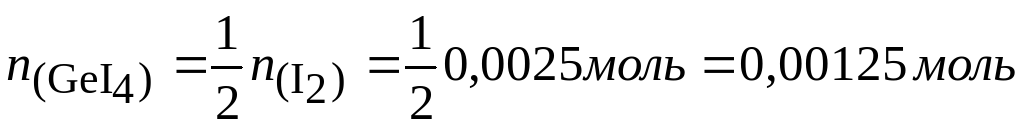
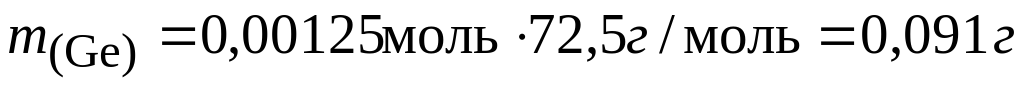
Система оценивания:
За уравнения реакций по 2 балла - 4 балла
За объяснения равновесий - 5 баллов
За расчет потерь - 3 балла
Итого: 10 баллов
10-4
Уравнения oписанных процессов:
2Ме1 + Н2 = 2Ме1Н (1)
Ме2 + Н2 = Ме2Н2 (2)
Ме1Н + Н2О = Ме2ОН + Н2 (3)
Ме2Н2+ 2Н2О = Ме2(ОН)2 + 2Н2 (4)
Нерастворимыми карбонатами являются соли щелочно-земельных металлов, поэтому:
Ме2(ОН)2 + Na2CO3 = Me2CO3 + 2NaOH (5)
Me2CO3 + 2 HCl = Me2Cl2 + CO2 +Н2О (6).
По уравнению (6): n(CO2) = n (Me2CO3),
по условию задачи n(CO2) =V/Vm = 1,12 л : 22,4 л/моль = 0,05 моль.
Отсюда М(Me2CO3) = m/M = 7,38 : 0,05 = 147,6г/моль
M(Me2) = 147,6г/моль - 60 г/моль = 87,6 г/моль.
Щелочно-земельный металл – Sr.
Поскольку n(SrCO3) = n(Sr), m(Sr) = 0,05 моль⋅87,6 г/моль = 4,38 г.
Тогда m(Me1) = 8,98 – 4,38 = 4,6 г.
По уравнению (4) n(H2) = 2n(SrH2), по условию задачи n(H2) = 0,1 моль.
Суммарное количество вещества выделившегося газа:
n(H2) = PV/RT = 103,96 кПа⋅6,95/ 8,31⋅290K = 0,3 моль.
Следовательно, Ме1 выделил n(H2) = 0,3 – 0,1 = 0,2 моль.
Отсюда по уравнению (3) n(Me1Н) = n(H2)= 0,2 моль.
По уравнению (1) n(Me1Н) = n(Me1), по условию n(Me1)= 0,2 моль.
Отсюда М(Ме1) = 4,6 : 0,2 = 23 г/моль.
Щелочной металл – Na.
Cистема оценивания:
За написание уравнений 1-6 по 0,5 балла - 3 балла
За определения стронция - 3 балла
За определение натрия - 4 балла
Итого: 10 баллов
10 -5
При нагревании спиртов выше 170 °С образуются алкены, поэтому
D – этилен С2Н4, Е – этан С2Н6, F – сажа.
Так как из вещества С образуется при восстановлении С2Н5ОН,
то С – уксусный альдегид СН3СНО, В — ацетилен С2Н2, А — карбид кальция СаС2, Н – гидроксид кальция Са(OН)2 , J – хлорид кальция СаС12, I – гидрокарбонат кальция Са(НСO3)2, К – карбонат кальция СаСO3, L – оксид кальция СаО,
1. СаС2 (А) + 2H2O → С2Н2 (В) + Са(ОН)2 (Н)
2. С2Н2 (В) + Н2O → СН3СНО (С)
3. CH3CHO (С) + Н2 → СН3СН2ОН
4. С2Н5ОН → Н2O + СН2=СН2 (D)
5. СН2=СН2 (D) + Н2 → CH3-CH3 (E)
6. С2Н6 (Е) → 3Н2 + 2С(F)
7. Са(ОН)2 (Н) + 2HCI → 2Н2O + CaCl2 (J)
8. CaCl2 (J) + Na2CO3 → CaCO3 + 2NaCl
9. CaCO3 + CO2 + H2O →Ca(HCO3)2 (I)
10. Ca(HCO3)2 (I) → CO2 + H2O + CaCO3 (К)
11. CaCO3 (K) → CO2 + CaO (L)
12. 2CaO + 5C → 2CaC2 + CO2
Система оценивания:
1. За определение веществ A-L по 0,5 балла - 5,5 баллов
2. За составление уравнений 1 - 6 – по 0,25 балла - 1,5 баллa
за составление уравнений 7 - 12 – по 0,5 балла - 3 балла
Всего:10 баллов
11 класс
11-1.
1. Растворение соли B в растворе аммиака:
CuCl + 3NH3 ⋅ H2O = [Cu(NH3)2]OH + NH4Cl (1)
Окисление комплекса меди(I) в комплекс меди(II):
4[Cu(NH3)2]OH + 2 H2O + O2 + 8 NH3 = 4[Cu(NH3)4](OH)2 (2)
Примеры стабильных солей меди(I): CuCl, CuI, CuSCN
2. Вещества: B – CuCl, C - CaC2; D - H2C2; F - Cu2C2; J - CO2; H - CaCO3;
Уравнения происходящих реакций:
Реакция карбида кальция с водой:
CaC2 + 2H2O = H2C2↑ + Ca(OH)2 (3)
Взаимодействие аммиаката меди (I) с ацетиленом с образованием красного осадка ацетиленида меди (I):
H2C2 + 2 [Cu(NH3)2]OH = Cu2C2↓ + 2 NH3 + 2 H2O (4)
Реакция сгорания ацетиленида меди(I):
Cu2C2 + 3O2 = 2CuO + 2 CO2↑ (5)
При горении пламя окрашивается медью в характерный зеленый цвет;
Взаимодействие углекислого газа с гидроксидом кальция в водном растворе.
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O (6)
Решение задачи начинают с последнего уравнения реакции
По условию задачи:
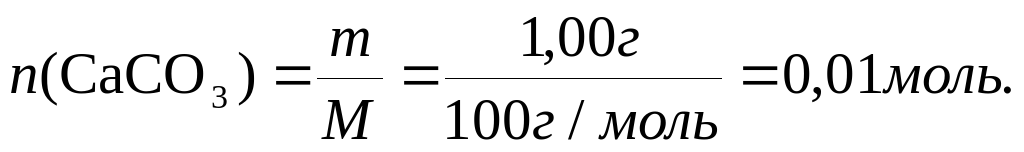
По цепочке последовательных уравнений реакций количества вещества соотносятся: 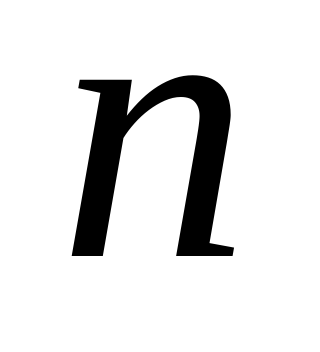 (CaC2)=
(CaC2)= 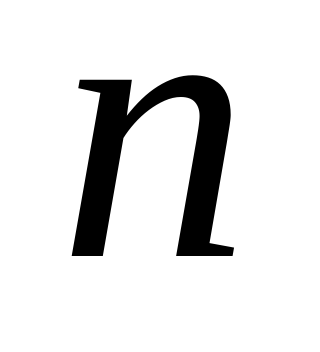 ( H2C2)=
( H2C2)= 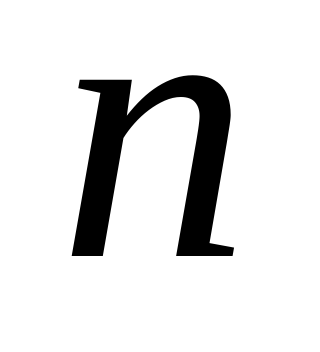 ( Cu2C2)= 2
( Cu2C2)= 2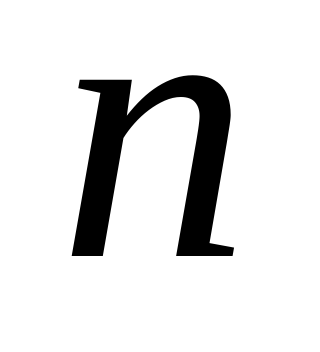 (CO2)= 2
(CO2)= 2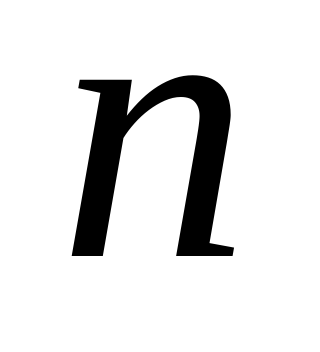 CaCO3
CaCO3
Следовательно, вычисляем количество 100%-ного карбида кальция:
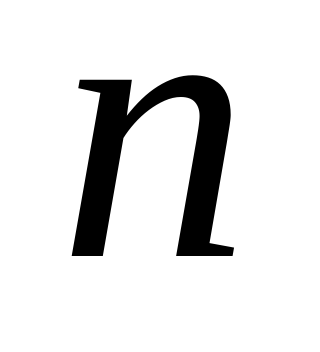 (CaC2)=1/2 ∙
(CaC2)=1/2 ∙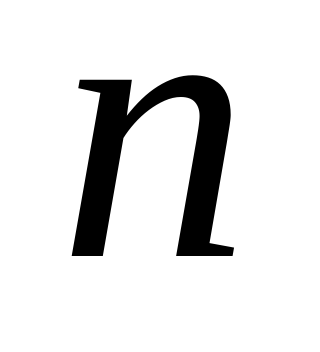 CaCO3= 0,01 / 2= 0,005
CaCO3= 0,01 / 2= 0,005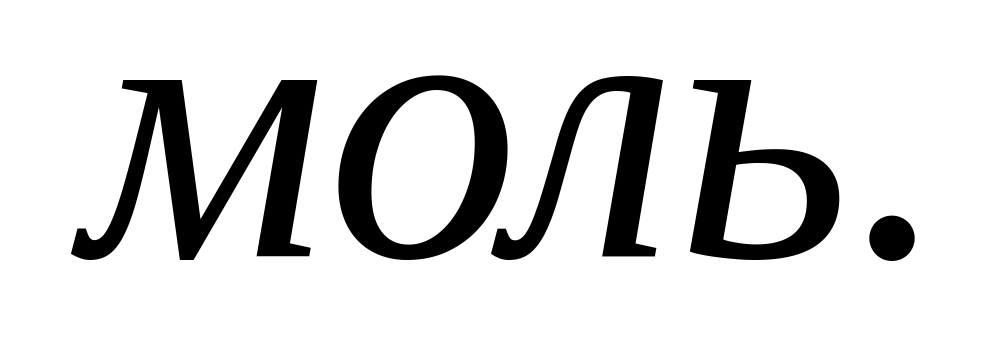
m(100%CaC2)= n ∙ M = 0,005∙64.10=0,32  .
.
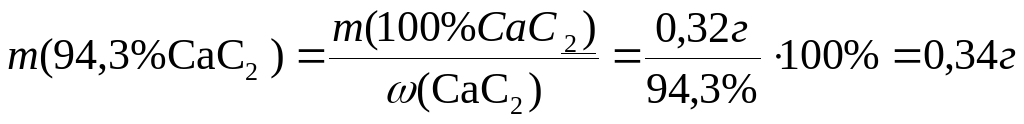
Система оценивания:
1. За уравнения 1,2 и примеры солей - 2 балла
2. За определенные вещества B - H по 0,5 балла за каждое - 3 балла
за уравнения реакций 3 и 6 по 1 баллу - 2 балла
за уравнения реакция 4 и 5 по 2 балла - 4 балла
3. За нахождение массы карбида кальция - 4 балла.
Всего:15 баллов
11-2
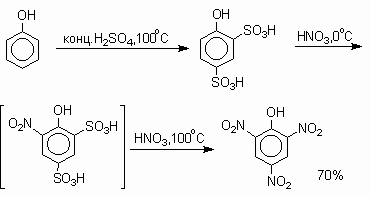
В банке находился фенол, известный во времена Холмса, как «карболовая кислота», в одной бутыли находилась азотная кислота, а в другой концентрированная серная кислота, известная также, как «купоросное масло». А желтые ядовитые взрывчатые кристаллы – это тринитрофенол, широко известный как пикриновая кислота.
Реакция получения тринитрофенола:
Под действием сульфида натрия происходит восстановление пикриновой кислоты в пикраминовую:

Название продукта восстановления – пикраминовая кислота, именно при помощи нее были открыты реакции диазотирования и азосочетания. Путем азосочетания получают азокрастели, которые до сих пор широко используются, например

Система оценивания:
1. За определение веществ, описанных в задаче - 2 балла
2. За составление уравнений химических реакций: получения тринитрофенола – 1 балл,
взаимодействия тринитрофенола с сульфидом натрия – 1 балл,
3. За название продукта восстановления пикриновой кислоты – 1 балл,
за название типа реакций - 1 балл,
за название соединений – 1 балл
пример уравнения реакций – 1 балл,
за уравнение реакции – 2 балла
Всего:10 баллов
11 – 3.
Уравнение сгорания кислоты:
СН3СООН + 2О2 = 2СО2 + 2Н2О
По следствию из закона Гесса:
∆Н0 = 2∆Нобр(СО2) + 2∆Нобр(Н2Ог) - ∆Нобр(СН3СООН) =
2⋅( -393,5) -2⋅(-241,8) + 484,2 = -786,4 кДж/моль.
n(СН3СООН) = ∆Н/∆Н0 = (-235,9) : (-786,4) = 0,3 моль.
nпрореаг(О2) = 0,6 моль
nост(О2) = PV/RT = 104,1⋅10,0 / (8,31⋅313) = 0,4 моль.
В исходной смеси было 0,3 моль СН3СООН и 1 моль О2.
m (СН3СООН) = 0,3 моль⋅60 г/моль = 18 г
m(О2) = 32 г.
ω (СН3СООН) = 18/(18+32) = 0,36
ω(О2) = 0.64
Система оценивания:
За уравнение реакции – 1 балл
За расчет энтальпии реакции - 2 балла
За расчет количества прореагировавших веществ – 1 балл
За расчет количества оставшегося кислорода – 1 балл
За расчет массовых долей – 1 балл
Итого: 6 баллов
11 -4
3(NH4)2S + Al2(SO4)3 + 6Н2О = t 2Al(OH)3 + 3H2S + 3(NH4)2SO4
(NH4)2SO4 + (C2H5)3N + 2Н2О = 2NH3⋅ Н2О + [C2H5)3NH]HSO4 или
(NH4)2SO4 + 2(C2H5)3N + 2Н2О = 2NH3⋅ Н2О + [C2H5)3NH]2SO4
а) FeS + H2SO4 разб =t Fe SO4 + H2S
б) FeS + 10H2SO4 конц =t Fe2 (SO4)3 + 9SO2 + 10Н2О
C6H5ONa + SO2 + Н2О = C6H5OH↓ +NaHSO3
а)15Mg + Fe2 (SO4)3тв = t 12MgO + 3MgS +2Fe (большой избыток магния)
б) Mg + Fe2(SO4)3 = MgSO4 + 2FeSO4 в водном растворе
Система оценивания:
За уравнения 1, 2, 3а 4 по 1 баллу - 4 балла
За уравнения 3б, 5а, 5б по 2 балла - 6 баллов
Итого: 10 баллов
11 -5
При бромировании избытком брома из фенола образуется исключительно 2,4,6-трибромфенол, а при бромировании о-крезола в тех же условиях соответствующее дибромпроизводное:
C6H5OH +3Br2 = Br3C6H2OH + 3HBr
CH3C6H4OH + 2Br2 = CH3Br2C6H2OH + 2HBr
При вычитании из массы бромпроизводных массы свободных фенолов получаем массу присоединенного брома: m (Br) = 15,28 – 4,99 = 10,29 г
По ней находим количество присоединившегося брома:
n(Br) = 10, 29 : 80 = 0,13 моль
Принимаем за x количество вещества фенола, а за у – количество вещества о-крезола.
Далее составляем систему уравнений:
94,1х+108,2у = 4,99
3х+2у=0,13
Решая систему, получаем x = 0,03моль фенола и y = 0,02моль о-крезола.
Система оценивания:
За уравнения реакций по 1 баллу - 2 балла
За расчет количества вещества присоединенного брома - 1 балл
За расчет по системе уравнений – 6 баллов.
Итого: 9 баллов






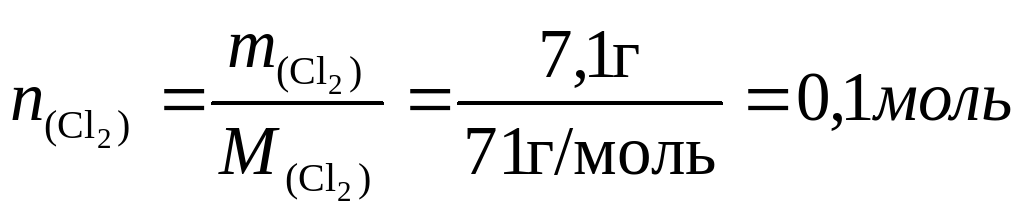
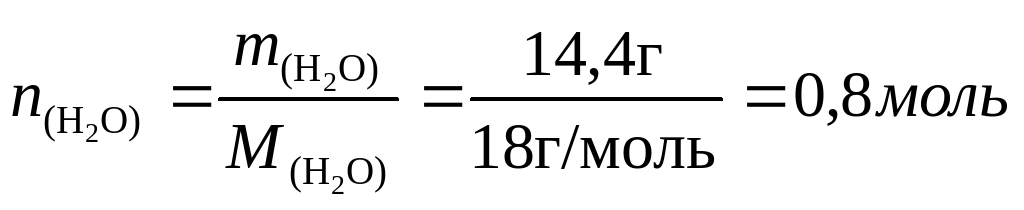
 0х + 98y = 50
0х + 98y = 50