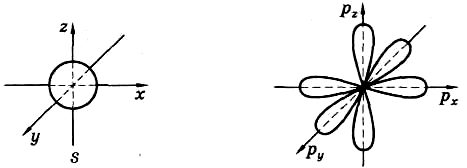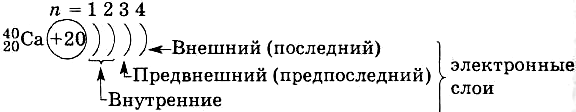Опорные конспекты по общей химии.
Строение атома.
Состав атома.

Состояние ē в атоме.
(т. е. информация о его энергии и нахождении в атоме)
Атомная орбиталь — часть атомного пространства, в которой вероятность нахождения данного ē наибольшая
Формы орбиталей:
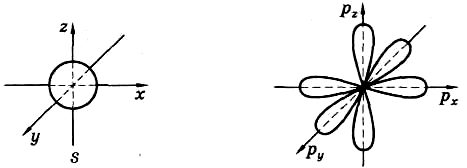
d, f — более сложной формы.
Энергетический уровень (п) — совокупность орбиталей, имеющих близкие по значению энергии и размеры.
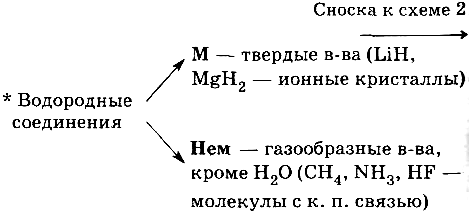
Электронный слой (п) — совокупность ē, занимающих данный энергетический уровень. Количество электронных слоев в атоме равно номеру периода.
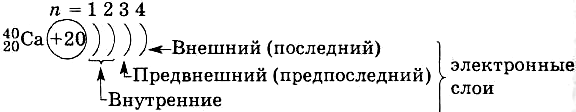
Энергетический подуровень — совокупность орбиталей на одном энергетическом уровне, имеющих одинаковую форму и отличающихся направленностью в пространстве. Количество подуровней на энергетическом уровне равно номеру энергетического уровня (п).
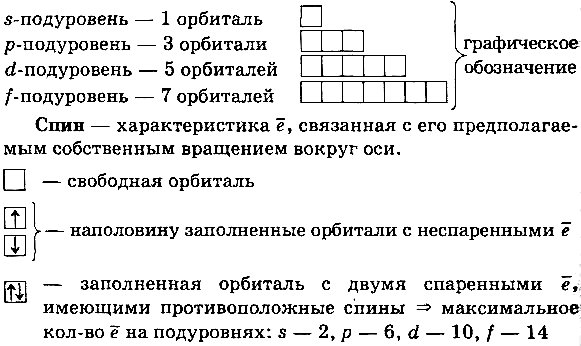

Принципы заполнения орбиталей электронами.
1. Принцип наименьшей энергии — электроны заполняют орбитали в порядке увеличения их энергии.
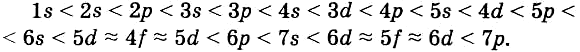
2. Принцип Паули — на одной орбитали не может быть более 2 электронов.
3. Правило Хунда — в пределах подуровня ē (с одинаковыми спинами) сначала заполняют свободные орбитали по одному, а затем спариваются.
Строение электронных оболочек атомов.
(электронные конфигурации)
I период

II период

Периодический закон и Периодическая система химических элементов (ПСХЭ)
Д. И. Менделеева (1869).
Современная формулировка ПЗ.
Свойства элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины заряда их атомных ядер.
ПСХЭ — графическое выражение ПЗ.
1. Порядковый номер элемента численно равен заряду ядра и общему количеству ē, что определяет
строение электронной оболочки атома и его свойства.
2. Период — горизонтальный ряд элементов с одинаковым числом электронных слоев, равным номеру
периода. Периоды начинаются Мщ и заканчиваются галогеном (Г) и инертным газом.
Исключения: I период начинается с Н, не содержит Г; VII период незавершен.
I, II, III — малые периоды; IV, V, VI — большие.
3. Группа — вертикальный столбец элементов с одинаковым числом валентных ē, равным номеру группы
(высшей степени окисления для большинства элементов).

4. Лантаноиды и актиноиды — f-элементы, располагаются в нижней части ПСХЭ (короткая форма);
их по 14, что равно максимальному количеству ē на f-подуровне.
Вывод: расположение элементов в ПСХЭ полностью объясняется характером заполнения электронами
энергетических уровней и подуровней.
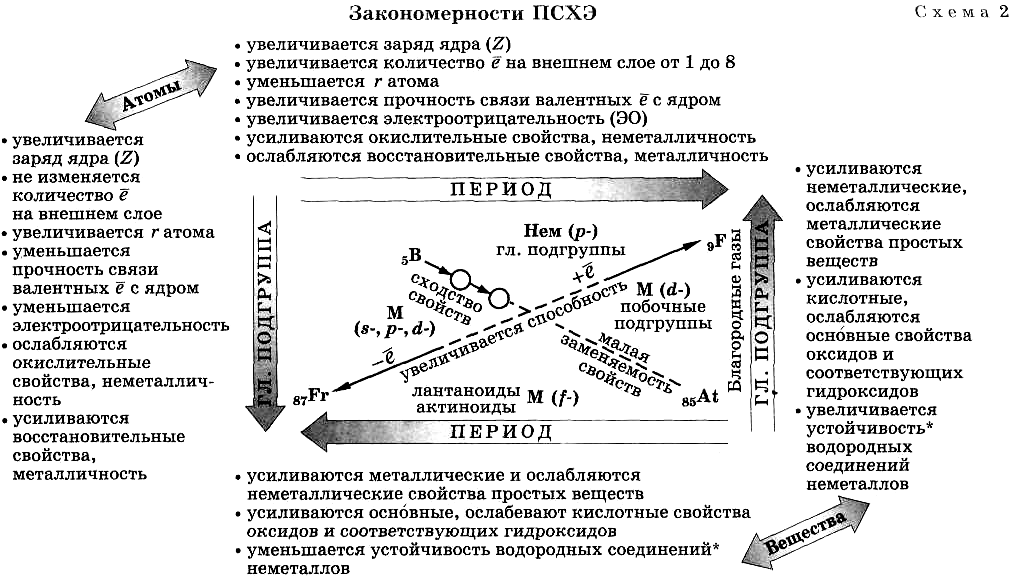
Закономерности ПСХЭ.
Каждый элемент в ПСХЭ находится на пересечении трех закономерностей: по периоду, по подгруппе, по диагонали (схема 2).
Физический смысл ПЗ — свойства элементов и образованных ими веществ изменяются периодически, так как периодически повторяются (с увеличением Z) электронные конфигурации атомов.
Наличие и учет всех трех закономерностей ПСХЭ («звездность» системы) — основа предсказательной функции ПЗ.