Просмотр содержимого документа
«Основания: состав, свойства, применение»

ТЕМА УРОКА: ОСНОВАНИЯ
8 класс, МБОУ СОШ №60
Трубникова Е.В.

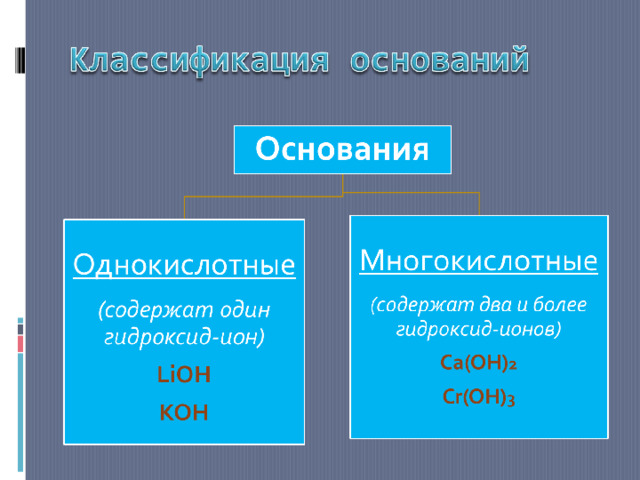
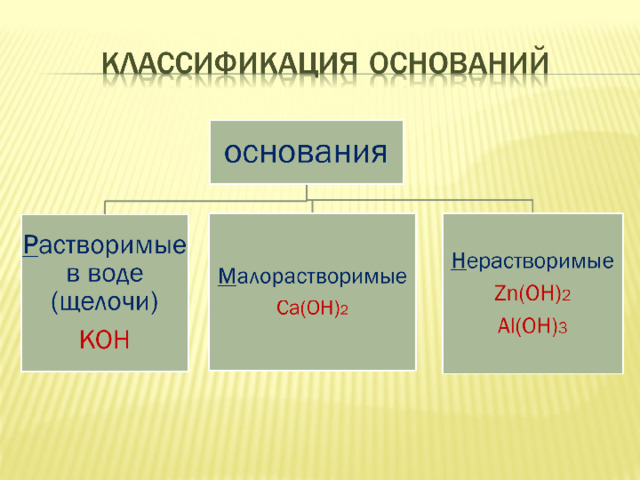
Основания – сложные вещества, состоящие из атома металла и одной или нескольких групп (ОН - )(гидроксильная группа).
ОБЩАЯ ФОРМУЛА
Ме(ОН) n , где n валентность металла

Номенклатура оснований
«гидроксид»
+
Название металла в родит. падеже
+
(ст. ок-я римскими цифрами)
гидроксид натрия
NaOH
Fe(OH) 3
гидроксид железа ( III )

Тривиальные названия щелочей
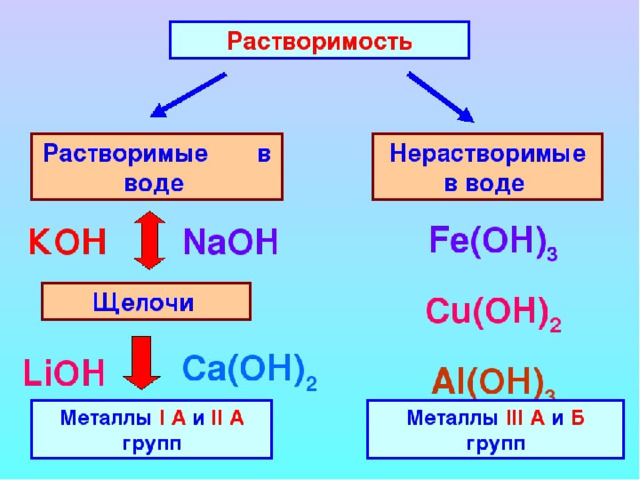
NaOH – едкий натр = каустическая сода
KOH – едкое кали
Са(ОН)2 – известковая вода = гашеная известь



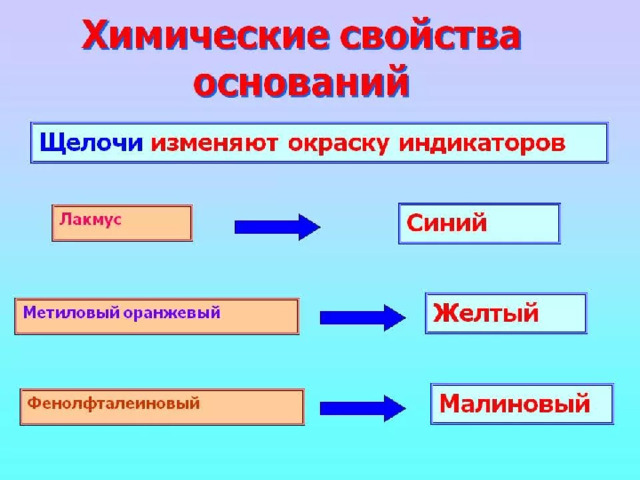
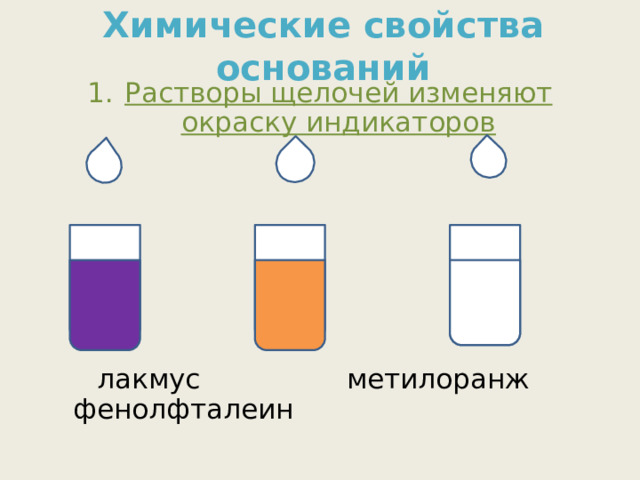
Химические свойства оснований
- Растворы щелочей изменяют окраску индикаторов
лакмус метилоранж фенолфталеин
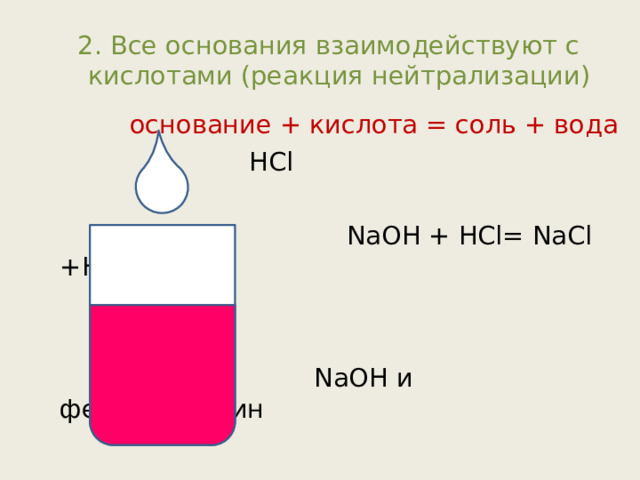
2. Все основания взаимодействуют с кислотами (реакция нейтрализации)
основание + кислота = соль + вода
HCl
NaOH + HCl= NaCl +H 2 O
NaOH и фенолфталеин


С u(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
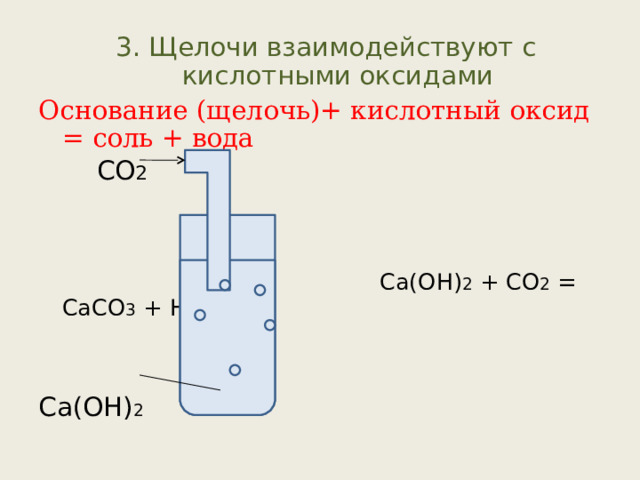
3 . Щелочи взаимодействуют с кислотными оксидами
Основание (щелочь)+ кислотный оксид = соль + вода
СО 2
Са(ОН) 2 + СО 2 = СаСО 3 + Н 2 О
Са(ОН) 2

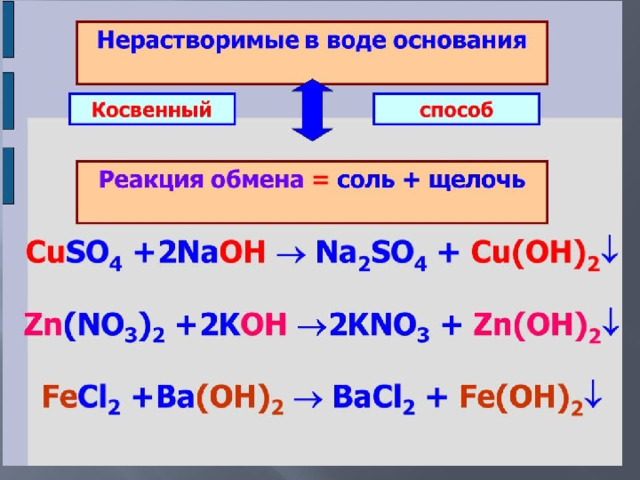
4. Щелочи взаимодействуют с растворами солей (если в их состав входит металл, способный образовывать нерастворимое основание)
Fe 2 (SO 4 ) 3 + 6 KOH = 2Fe(OH) 3 + 3 K 2 SO 4
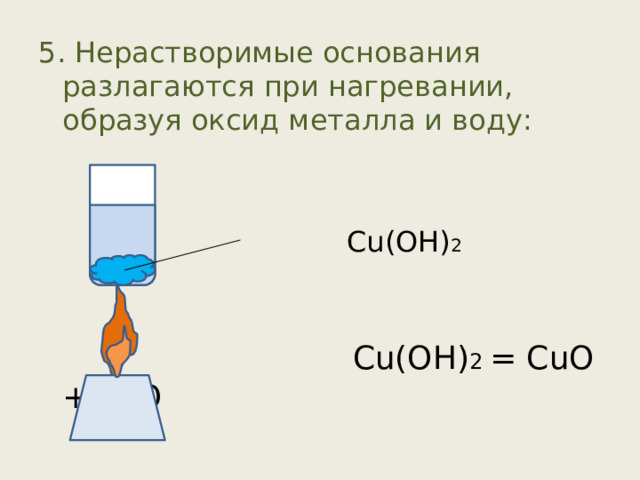
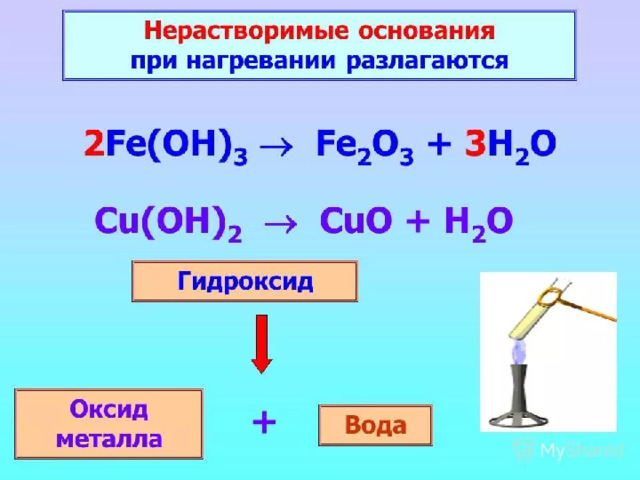
5 . Нерастворимые основания разлагаются при нагревании, образуя оксид металла и воду:
С u(OH) 2
С u(OH) 2 = CuO + H 2 O

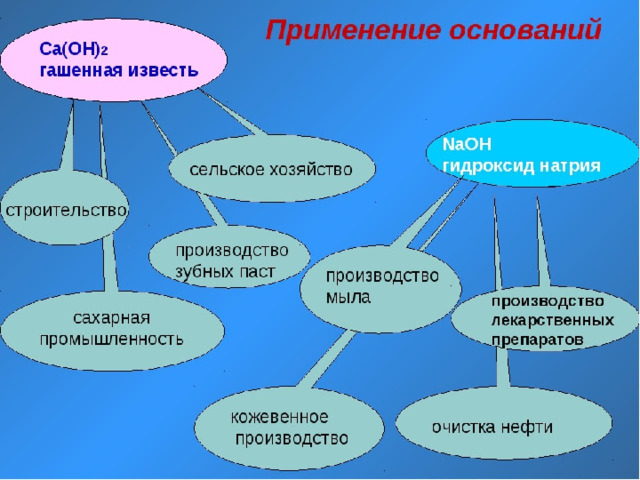

Задание на дом : параграфы 41,42 упр.2 стр.139; упр 2 стр144
Урок окончен!!!








































