
МБОУ «Бестяхская СОШ» г.Покровск
- Урок химии в 11 классе
- Учитель: Протодьяконова Л.И.


Цель урока:
- Повторить теоретический материал по данному вопросу.
- Проделать упражнения.

Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.

- это связь, возникающая между атомами за счет образования общих электронных пар.
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
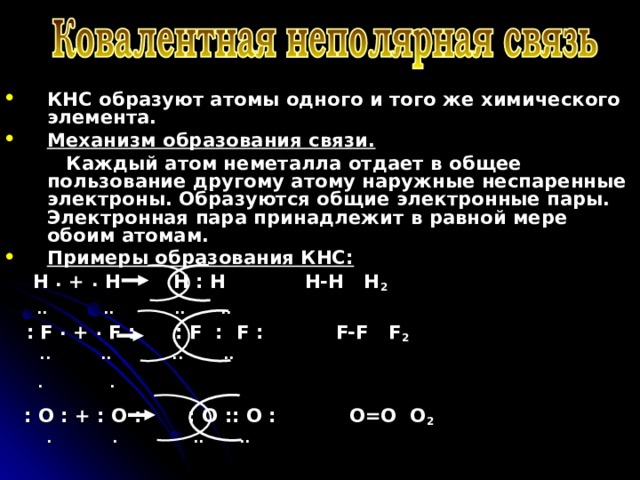
- КНС образуют атомы одного и того же химического элемента.
- Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные неспаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
H . + . H H : H H-H H 2
.. .. .. ..
: F . + . F : : F : F : F-F F 2
.. .. .. ..
. .
: O : + : O : : O :: O : O=O O 2
. . .. ..

Вещества с КНС имеют:
Молекулярную кристаллическую
решетку ( все остальные)
Атомную кристаллическую
решетку ( C, Si, B)
Свойства веществ:
- При обычных условиях вещества газообразные ( H 2 , O 2 ) , жидкие ( Br 2 ), твердые ( I 2 );
- Большинство веществ сильно летучие, т.е. имеют низкие t o кипения и плавления;
- Растворы и расплавы не проводят электрический ток.
Свойства веществ:
- Твердые;
- Имеют высокие температуры плавления.

- КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Электроотрицательность (ЭО)- это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – F .
- Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
- Примеры образования связи.
.. .. + -
H + . Cl H . Cl : H Cl + - Диполь
.. ..

Вещества с КПС имеют:
Молекулярную кристаллическую
решетку (все остальные)
Свойства веществ:
- При обычных условиях вещества газообразные, жидкие, твердые;
- Большинство веществ сильнолетучие, т.е. имеют низкие t o кипения и плавления;
- Растворы и расплавы проводят электрический ток.
Атомную крисаллическую
Решетку ( SiC, SiO 2 )
Свойства веществ:
- Твердые;
- Имеют высокие t o плавления.
![ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности. Механизм образования связи. Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Пример образования связи. .. .. Na + . Cl : [ Na ] + [ . Cl : ] - или Na + Cl - .. .. 9](https://fsd.multiurok.ru/html/2019/10/14/s_5da4244f76eea/img9.jpg)
- ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности.
- Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами.
- Пример образования связи.
.. ..
Na + . Cl : [ Na ] + [ . Cl : ] - или Na + Cl -
.. ..
9

Вещества с ИС имеют :
Ионную кристаллическую решетку
Свойства веществ:
- Все вещества при обычных условиях твердые.
- Имеют высокие температуры кипения и плавления.
- Расплавы и растворы проводят электрический ток.

- Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
- Схема образования металлической связи (М – металл):
_
М 0 – ne M n+
Твердость, ковкость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.

- Водородная связь – связь между атомами водорода одной молекулы и сильноотрицательными элементами ( O, N, F) другой молекулы.
- Примеры межмолекулярной водородной связи:
… О - - Н + … О - - Н + …
| |
H + H + вода
… О - - Н + … О - - Н + …
| | +
С 2 H 5 + С 2 H 5 этиловый спирт

- Механизм возникновения связи:
Протон одной молекулы притягивается неподеленной электронной парой атома другой молекулы.
водородные соединения F, O, N ( реже Cl и S ), спирт. Белки, нуклеиновые кислоты и др.

В каком ряду написаны вещества только с ковалентной полярной связью?
а) хлор, аммиак, хлороводород
б) бромоводород, оксид азота (+2), бром
в) сероводород, вода, сера
г) иодоводород, вода, аммиак

Термин «молекула» нельзя употреблять при характеристике строения
1) сероводорода
2) азотной кислоты
3) озона
4) фторида кальция

Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная

Различие в значении температур плавления CO2 (- 56,6) и SiO2 (+ 1728) объясняется
1) различием в строении атомов углерода и кремния
2) различием в значениях масс молекул
3) разным видом химической связи
4) разным типом кристаллической решётки

В веществе CH3 – CH3 связь между атомами углерода
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) водородная
2

Установите соответствие между формулой вещества и видом химической связи
Формула вещества Вид химической
связи
А) I2 1) КПС
Б) ZnSO4 2) КНС
В) К 2S 3) ИС, КПС
Г) Н2О 4) ВС
5) ИС
6) КНС, КПС
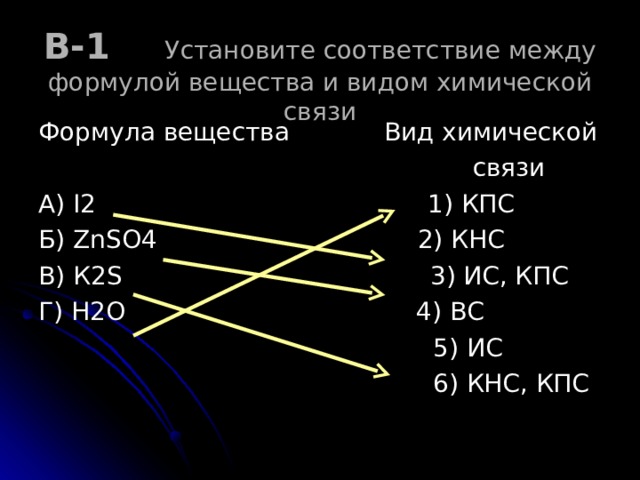
В-1 Установите соответствие между формулой вещества и видом химической связи
Формула вещества Вид химической
связи
А) I2 1) КПС
Б) ZnSO4 2) КНС
В) К 2S 3) ИС, КПС
Г) Н2О 4) ВС
5) ИС
6) КНС, КПС

















![ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности. Механизм образования связи. Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Пример образования связи. .. .. Na + . Cl : [ Na ] + [ . Cl : ] - или Na + Cl - .. .. 9](https://fsd.multiurok.ru/html/2019/10/14/s_5da4244f76eea/img9.jpg)























